Компенсаторные механизмы | Блог 4brain
 Испытывали ли вы когда-нибудь чувство неполноценности? Как вы с ним справлялись? Оно отравило вашу жизнь или стало двигателем при движении к целям? В статье мы обсудим, что такое реальная компенсация, сверхкомпенсация и псевдокомпенсация, и научимся их различать. А чтобы больше погрузиться в эту тему, узнать свои исльные и слабые стороны, приходите на нашу онлайн-программу «Самопознание».
Испытывали ли вы когда-нибудь чувство неполноценности? Как вы с ним справлялись? Оно отравило вашу жизнь или стало двигателем при движении к целям? В статье мы обсудим, что такое реальная компенсация, сверхкомпенсация и псевдокомпенсация, и научимся их различать. А чтобы больше погрузиться в эту тему, узнать свои исльные и слабые стороны, приходите на нашу онлайн-программу «Самопознание».
Что такое компенсаторные механизмы?
Компенсаторные механизмы в психологии – это механизмы, направленные на восполнение, уравновешивание и возмещение чего-либо, но при этом не объясняющиеся в полной мере принципом гомеостаза. При компенсации утраченная психическая функция заменяется более приемлемой для человека способностью.
Впервые компенсаторные механизмы были рассмотрены психоаналитиками. Альфред Адлер считал, что неполноценность и её компенсация – это нормальное состояние человека. Он активно разрабатывал тему компенсаторных механизмов и выделял 3 вида неполноценности:
- Физиологическая неполноценность. Отсутствие частей тела, зрения, слуха и т.д.
- Социально-культурная неполноценность. Сюда входят неравенство социальных ролей, возрастные, половые, политические и экономические различия, вызывающие чувство неполноценности индивида.
- Изначальная неполноценность человека. Это биологическая неполноценность человека вообще. По Адлеру, именно из стремления преодолеть эту неполноценность появились язык, техника, религия, мораль, наука, искусство, социальная организация и другие проявления культуры.
Зигмунд Фрейд критиковал подход Адлера, указывая, что далеко не все люди, которые чем-то ограничены, испытывают чувство неполноценности. Люди, лишённые зрения или слуха, могут быть даже излишне самоуверенными, люди с ампутированными конечностями могут чувствовать себя полноценными членами общества, не испытывая никаких притеснений. Фрейд утверждал, что людей, склонных к нарциссизму, встретить гораздо легче, чем тех, кто испытывает комплекс неполноценности.
На эту критику Адлер отвечал, что «комплекс неполноценности» – это только идея, способ объяснить некоторые психологические процессы. Речь не идёт о фактической полноценности, т.к. её критерии относительны и могут отличаться в различных культурах.
Неполноценность – это чувство, дающее нам приток сил и побуждающее к действию. Если человек ощущает себя неполноценным, он стремится к компенсации. Говоря о компенсации, Адлер использовал 3 термина: реальная компенсация, сверхкомпенсация и псевдокомпенсация. Рассмотрим каждое из них.
1
Реальная компенсация
Реальная компенсация – это адаптация к условиям жизни. Несмотря на то, что ранее человек испытывал неполноценность, сейчас он отлично приспособлен ко всем жизненным ситуациям. Условиями реальной компенсации Адлер называл:
- стремление к превосходству;
- стремление к власти;
- упорство;
- социальное чувство (интерес к людям, общественным процессам и т.д. – это побуждает индивида включиться в процесс компенсации).
Адлер был убеждён, что реальной компенсации достигает большинство индивидов, испытывавших чувство неполноценности.
2
Сверхкомпенсация
Сверхкомпенсация – это усиленное внимание к слабому органу или способности, его/её усиленные тренировки, либо развитие других органов и способностей, которые, при наличии благоприятных условий, приводят к выдающемуся результату. Например, человек, которому трудно общаться с людьми, может компенсировать свою социальную неловкость успехами в изучении какой-либо науки. Из-за сверхкомпенсации изначально неполноценный человек может стать гением.
3
Псевдокомпенсация
Псевдокомпенсация – это своего рода шантаж, при котором компенсация достигается не за счет развития, а за счёт других людей. Адлер выделял три ситуации, которые располагают к возникновению псевдокомпенсации:
- наличие таких физиологических недостатков, которые приводят к недомоганию и психологической перегрузке;
- гиперопека, чрезмерная забота и атмосфера всепрощения способствуют формированию у индивида нездорового эгоизма, капризности, неспособности к сотрудничеству, нетерпимости, желания брать, ничего не отдавая взамен;
- пренебрежение, недостаток любви, отсутствие душевной близости и откровенных разговоров о проблемах приводят к недоверию людям, неспособности любить и дружить.
При этом псевдокомпенсация осуществляется следующими способами:
- Уход в болезнь. Человек любой промах оправдывает своей неполноценностью, он ожидает, что, даже если она никак не повлияла, ему должны сделать поблажку. Это помогает избегать проблем. Также уход в болезнь позволяет индивиду манипулировать другими людьми, давить им на чувство жалости. Он пользуется сочувствием других ради самоутверждения и достижения своих целей.
- Уход в слабость. Это осознанный выбор пути жертвы. Такие люди намеренно выбирают себе самое худшее, гасят свои амбиции, не пытаются ничего добиться. Их слабость и беспомощность – источник чувства морального превосходства.
- Комплекс превосходства. Чтобы убежать от чувства неполноценности, человек начинает культивировать в себе ощущение незаменимости.
- Лень. Индивид с комплексом неполноценности просто отказывается что-либо делать, чтобы избежать трудностей.
- Самореклама. Люди, страдающие от собственной неполноценности, начинают стремиться обратить на себя внимание окружающих, они пытаются показать себя с лучшей стороны, вызвать одобрение и получить положительную стимуляцию. Это приводит к сильной зависимости от чужого мнения.
Таким образом, от выбора способа компенсации зависит весь жизненный путь человека. Если он с детства будет заниматься псевдокомпенсацией, он обречён на жалкое существование. Если же он направит свою энергию на сверхкомпенсацию, он сможет стать выдающимся человеком.
Поэтому полезно проанализировать свою жизнь и задать себе несколько вопросов:
- Испытывал ли я когда-нибудь чувство неполноценности? Испытываю ли я его сейчас?
- К какому способу компенсации я прибегал ранее и прибегаю сейчас?
- Удовлетворяет ли меня мой способ компенсации? Не стоит ли попытаться изменить свою модель поведения?
Итого
Давайте подведём итоги:
- испытывать чувство неполноценности – это нормально;
- избавиться от чувства неполноценности можно путем реальной компенсации, сверхкомпенсации или псевдокомпенсации;
- реальная компенсация – это адаптация к условиям жизни;
- сверхкомпенсация – это достижение выдающихся успехов, обусловленное стремлением избавиться от чувства неполноценности;
- псевдокомпенсация – это избавление от чувства неполноценности за счет манипуляции окружающими.
Как видите, даже комплекс неполноценности не является непреодолимой преградой на пути к жизненным достижениям. Главное – правильно с ним справляться.
Желаем успехов!
Процессы приспособления и компенсации — Википедия
Приспособле́ние в (адапта́ция) к меняющимся условиям существования является наиболее общим свойством живых организмов. Все патологические процессы, по существу, можно разделить на две группы: (1) процессы повреждения (альтеративные процессы) и (2) процессы приспособления (адаптивные процессы).
К механизмам, обеспечивающим приспособление, относятся специальные защитные системы, регуляция функций организма и избегающее поведение.
I. Специальные защитные системы, препятствующие наиболее разрушительным внешним воздействиям
- Иммунная система и система мононуклеарных фагоцитов как защита от генетически чужеродной экспансии
- Механизм воспаления и тесно связанный с ним феномен репаративной регенерации как универсальные способы восстановления повреждённых тканей
- Система антибластомной резистентности, препятствующая возникновению незрелых злокачественных опухолей
- Свёртывание крови (гемокоагуляция, тромбоз) как защита от потери внутрисосудистой жидкой ткани
- Стресс-система, обеспечивающая развитие стресс-синдрома.
II. Механизмы регуляции всех функций организма.
III. Избегающее поведение (его формирует ноцицептивная система).
Выделяют три стадии в развитии адаптивного процесса:
- Рецепция адаптогена (адаптогенного стимула) — восприятие изменения какого-либо параметра среды
- Регуляция адаптогенеза (настройка силы и длительности адаптивного ответа)
- Адаптивный ответ (адаптивная реакция) — изменение характера функционирования организма или его отдельных структур, соответствующее изменившимся внешним условиям.
Приспособительные реакции подразделяют на (1) ортоадаптивные, (2) дизадаптивные и (3) компенсаторные.
I. Ортоадаптация (оrtoadapt) – (orto — правильный, прямой; adapt — приспособляю) — метод воздействия на живой организм различными способами с учетом его индивидуальных особенностей, физических и психо-физиологических нарушений с целью их исправления и правильного приспособления к условиям окружающей среды. Ортоадаптация разделяется на динамическую ортоадаптацию и статическую ортоадаптацию.
Динамическая ортоадаптация – (dinamic – движение, orto — правильный, прямой; adapto — приспособляю) – метод воздействия на живой организм, используя различные виды и способы дозированной двигательной активности с учетом общего состояния организма, его индивидуальных особенностей, физических и психо-физиологических нарушений с целью их исправления, приспособления к условиям окружающей среды и ведения полноценного образа жизни.
Статическая ортоадаптация – (static-постоянство, orto — правильный, прямой; adapto — приспособляю) – метод воздействия на живой организм с использованием различных искусственных и естественных приспособлений и устройств для полноценной коррекции и создания его правильного положения в периоды сна, работы и отдыха, с учетом общего состояния организма, его индивидуальных особенностей, физических и психо-физиологических нарушений и с целью его приспособления к условиям окружающей среды и ведения полноценного образа жизни.
II. Дизадаптация (патологическая адаптация) — неадекватная приспособительная реакция
- Гиперадаптация — избыточный адаптивный ответ (аллергия; дистресс-синдром; фибринозное, геморрагическое и гнойное воспаление; гиперрегенерация)
- Гипоадаптация — недостаточность адаптогенеза (иммунодефицит, гипорегенерация)
- Анадаптация — неспособность к адаптивному ответу (крайняя степень гипоадаптации)
- Дезадаптация — срыв адаптации.
III. Компенсация (компенсаторные, или эксквизитные, реакции).
Дезадаптация (срыв адаптации) является вариантом анадаптивных состояний (приобретённая анадаптация). Дезадаптация представляет собой достижение предела адаптации для данного организма.
Исходами дезадаптации являются:
- Смерть организма при необратимой дезадаптации
- Реадаптация (восстановление приспособительных возможностей) при обратимой дезадаптации.
Аналогичные дезадаптации и реадаптации состояния в случае компенсаторных процессов обозначаются терминами «декомпенсация» и «рекомпенсация» соответственно.
Компенсация (компенсаторные процессы) — адаптация в условиях болезни, приспособление к патологическим условиям существования организма. Сформированное таким образом приспособление (стадия компенсации) рано или поздно завершается истощением функциональных возможностей и срывом компенсации — декомпенсацией (стадия декомпенсации). При декомпенсации жизненно важных функций наступает смерть организма. Рекомпенсация возможна только путём замены «изношенного» органа полноценным донорским (трансплантация органа). Таким образом, решение проблемы рекомпенсации зависит от успехов трансплантационной медицины.
Морфология приспособительных процессов[править | править код]
В отечественной патологической анатомии среди приспособительных процессов, помимо воспаления, иммунного ответа и тромбоза, традиционно рассматривают объёмные процессы (атрофию и гипертрофию), регенерацию, дисплазию, организацию и стресс-синдром.
Объёмные процессы[править | править код]
К объёмным процессам относят атрофию («негативный объёмный процесс») и гипертрофию («позитивный объёмный процесс»). Своеобразным вариантом гипертрофии является гиперплазия.
Гипертрофия и гиперплазия[править | править код]
Гипертрофи́я — увеличение объёма какой-либо биологической структуры (органа, ткани, клетки, органеллы). Исключением является организм в целом: не принято говорить о гипертрофии всего тела человека. Гипертрофия может быть врождённым процессом. Гиперплази́я — гипертрофия ткани за счёт увеличения количества образующих её клеток, т.е. в результате их активного деления. Гиперплазия — один из вариантов разрастания тканей (другой вариант — опухоль). В отличие от гиперплазии, опухолевый рост не является приспособительным процессом. Гипертрофия не всегда относится к патологическим процессам, в ряде случаев (нейрогуморальная гипертрофия) она носит физиологический характер.
Варианты гипертрофии классифицируют следующим образом:
I. Приспособительные (адаптивные) варианты
- Нейрогуморальная гипертрофия (физиологическая и патологическая)
- Гипертрофические разрастания.
II. Компенсаторные варианты
- Рабочая гипертрофия
- Викарная (заместительная) гипертрофия.
- Регенераторная гипертрофия.
III. Врождённая гипертрофия.
Нейрогуморальная гипертрофия — гипертрофия, развивающаяся под влиянием гормонов, стимулирующих деление клеток. Выделяют (1) физиологические и (2) патологические варианты нейрогуморальной гипертрофии. Примером физиологической нейрогуморальной гипертрофии является увеличение матки при беременности и молочных желёз при лактации. К патологической нейрогуморальной гипертрофии относятся гиперплазия эндометрия, нодулярная гиперплазия простаты, увеличение органов при синдромах гиперпродукции соматотропного гормона (гигантизме и акромегалии) и т.п.
Гипертрофические разрастания — разрастания тканей при нарушениях крово- и лимфообращения (фиброз), а также на фоне хронического воспаления (фиброэпителиальные и гиперпластические полипы). [Аденоматозные полипы, в отличие от гиперпластических и фиброэпителиальных, являются доброкачественными опухолями, разновидностью аденом.]
Рабочая гипертрофия — гипертрофия гиперфункционирующего органа. Типичным примером рабочей гипертрофии служит гипертрофия миокарда левого желудочка при длительной артериальной гипертензии.
Викарная гипертрофия — гипертрофия одного из парных органов при отсутствии (аплазия, хирургическое удаление), недоразвитии (врождённой гипоплазии) или приобретённой гипофункции другого. Наиболее характерна викарная гипертрофия почки. Викарную гипертрофию можно рассматривать как разновидность рабочей гипертрофии.
Регенераторная гипертрофия — гипертрофия паренхиматозных клеток органа вокруг рубца при субституции. Так, при инфаркте миокарда по периферии сформированного пост-инфарктного рубца сохранные кардиомиоциты существенно увеличиваются, тем самым частично компенсируя функцию погибших клеток. Регенераторная гипертрофия также является своеобразным вариантом рабочей гипертрофии.
Врождённая гипертрофия — один из видов пороков развития органов (например, врождённая гипертрофия больших слюнных желёз).
Атрофия[править | править код]
Атрофи́я — уменьшение объёма какой-либо биологической структуры (органа, ткани, клетки, органеллы) или организма в целом. Для того, чтобы произошло уменьшение объёма структуры, она должна быть соответствующим образом развита, поэтому атрофию необходимо отличать от врождённой гипоплазии (недоразвития органа). Следовательно, атрофия всегда является приобретённым процессом.
Атрофию подразделяют на местную и общую, физиологическую и патологическую.
I. Общая физиологическая атрофия.
II. Местная физиологическая атрофия (инволюция).
III. Общая патологическая атрофия (кахексия).
IV. Местная патологическая атрофия
- Дисфункциональная атрофия (атрофия от бездействия)
- Прессогенная атрофия (атрофия от давления)
- Нейротическая (нейролитическая) атрофия
- Атрофия при хроническом нарушении кровообращения
- Атрофия при действии химических и физических факторов
- Псевдогипертрофия.
Общая физиологическая атрофия развивается в старости: уменьшаются отдельные органы и организм в целом.
Инволюция («обратное развитие органов») также относится к атрофическим процессам физиологического характера, например, возрастная инволюция тимуса, пост-гравидарная инволюция эндометрия и т.п.
Кахексия (истощение, маразм) развивается при длительном полном голодании (алиментарная кахексия), хронических инфекционных заболеваниях (например, при туберкулёзе), злокачественных опухолях («раковая кахексия»), при тяжёлой гипофункции аденогипофиза («гипофизарная кахексия»), гипоталамуса («церебральная кахексия»). Для истощения характерна бурая атрофия миокарда и печени.
Дисфункциональная атрофия — атрофия гипофункционирующего органа (например, атрофические процессы в скелетных мышцах при длительной иммобилизации конечности).
Прессогенная атрофия — атрофия, вызванная длительным сдавлением органа или его части. Типичными примерами прессогенной атрофии являются атрофия мозга при гидроцефалии и атрофия почки при гидронефрозе. В первом случае ткань головного мозга сдавлена блокированным в желудочках ликвором, во втором — на ткань почки оказывает давление моча, переполняющая чашечно-лоханочную систему органа при нарушении её оттока.
Нейротическая атрофия — атрофия денервированной ткани. Правильно называть данный процесс «нейролитической артрофией», однако слог «-ли-» по какой-то причине выпал и термин стали использовать в усечённом варианте. Нейротическую атрофию можно рассматривать как разновидность дисфункциональной атрофии, т.к. функция денервированной ткани снижается или полностью выпадает.
Атрофия при хроническом нарушении кровообращения (хронической ишемии и хроническом застойном полнокровии) проявляется уменьшением объёма паренхимы органа, в то время как строма может подвергаться гипертрофии за счёт фиброза.
Атрофия при действии химических и физических факторов. Различные факторы химической и физической природы способны вызывать атрофический процесс. Так, ионизирующее излучение приводит к атрофии ткани красного костного мозга (радиогенная атрофия миелоидной ткани), длительное применение в больших дозах глюкокортикоидных гормонов способствует развитию атрофии пучковой зоны коры надпочечников и т.п.
Псевдогипертрофия — атрофия паренхимы при одновременной гипертрофии стромы органа. Данный процесс относится к вариантам атрофии, т.к. при этом функция органа снижается. Гипертрофия стромы может развиваться за счёт фиброза (например, при гипертрофическом циррозе печени) или липоматоза (например, так называемое вакатное ожирение скелетных мышц).
Организация[править | править код]
Организацией в отечественной патологической анатомии называют четыре формы фиброза:
- Организация детрита — замещение волокнистой тканью некротических масс
- Организация тромботических масс (организация тромба)
- Организация фибринозного экссудата
- Инкапсуляция — обрастание фиброзной тканью детрита, инородных тел или погибших паразитов с формированием соединительнотканной капсулы.
Дисплазия[править | править код]
Дисплази́я — нарушение дифференцировки (созревания) тканей и клеток.
Классификация[править | править код]
Различают дисплазию тканей и дисплазию клеток.
I. Дисплазия ткани
- Врождённая тканевая дисплазия
- Постнатальная тканевая дисплазия.
Варианты врождённой тканевой дисплазии
- Персисте́нция эмбриональных структур
- Гама́ртия
- Хори́стия (врождённая гетеротопи́я).
II. Дисплазия клеток
- Дисплазия I степени (интраэпителиальная неоплазия I степени)
- Дисплазия II степени (интраэпителиальная неоплазия II степени)
- Дисплазия III степени (вместе с карциномой in situ обозначается термином «интраэпителиальная неоплазия III степени»).
Тканевая дисплазия[править | править код]
Тканевая дисплазия — нарушение нормального соотношения элементов в ткани или появление структур, не встречающихся в норме.
Тканевая дисплазия может быть (1) врождённой или (2) развивается в постнатальном онтогенезе. Типичным примером постнатальной тканевой дисплазии является доброкачественная дисплазия молочной железы (фиброзно-кистозная болезнь, мастопатия), при которой в ткани молочной железы увеличивается пропорция эпителиальных клеток («пролиферативная форма») или стромы («непролиферативная форма»). При дисплазии тимуса обычно увеличено количество эпителиальных клеток и снижено число тимоцитов.
Врождённая тканевая дисплазия проявляется тремя типами изменений: (1) персистенцией эмбриональных структур, формированием (2) гамартий и (3) хористий. Эмбриональные структуры (карман Ратке, жаберные щели, хорда и т.п.) в определённые сроки антенатального онтогенеза должны подвергаться инволюции. Если этого не происходит, их существование затягивается (эмбриональные структуры персистируют), т.е. в ткани остаются элементы, которых уже быть не должно. Гама́ртией называется избыточно развитый нормальный компонент ткани (например, кровеносные сосуды в ткани врождённых гемангиом, меланоциты в невусах). Хори́стия (врождённая гетеротопи́я) — появление в созревшей ткани нехарактерных для неё структур (например, ткани слюнных желёз в челюстных костях или панкреатической ткани в стенке желудка). Персистирующие эмбриональные структуры, гамартии и хористии могут служить источником развития опухолей (прогономы, гамартомы, хористомы), в том числе злокачественных.
Клеточная дисплазия[править | править код]
Дисплазия клеток — предраковый процесс, характеризующийся появлением признаков клеточного атипизма.
Выраженность клеточной дисплазии различная. Ранее выделяли три степени дисплазии клеток (лёгкая, умеренная и тяжёлая), в настоящее время часто ограничиваются двумя крайними степенями (low grade и high grade). Клеточная дисплазия особенно детально изучена для эпителиоцитов разных органов. В последние два десятилетия термин «клеточная дисплазия» (также как и термин «карцинома in situ») в патологоанатомической и онкологической практике заменён термином «интраэпителиальная неоплазия». При этом в рубрику «тяжёлой интраэпителиальной неоплазии» (III степени) включена тяжёлая дисплазия клеток (дисплазия III степени) и карцинома in situ. Тяжёлая форма клеточной дисплазии относится к облигатному предраку.
Регенерация[править | править код]
Регенера́ция — обновление и восстановление тканей.
Классификация[править | править код]
Формы регенерации классифицируют следующим образом:
I. Характер процесса
- Физиологическая регенерация
- Репаративная регенерация (репарация)
- Патологическая регенерация.
Формы репарации:
- Реституция
- Субституция.
Формы патологической регенерации:
- Гиперрегенерация
- Гипорегенерация
- Метаплазия.
II. Особенности восстановления клеток
- Внутриклеточная регенерация
- Клеточная регенерация.
Физиологическая регенерация — обновление тканей. Физиологическая регенерация протекает постоянно во всех тканях организма, но с разной скоростью. Наиболее быстро обновляется миелоидная и лимфоидная ткань, а также эпителиальная выстилка желудка и кишечника. Очень медленное обновление происходит в скелетных (костной и хрящевой) тканях.
Регенерацию повреждённых тканей (т.е. их восстановление) подразделяют на репаративную и патологическую. Репаративная регенерация (репарация) — восстановление повреждённых тканей, при котором процесс регенерации протекает нормально, хотя и быстрее физиологической регенерации. Различают две формы репарации: реституцию и субституцию. Реституция — полное восстановление повреждённой ткани. Образовавшаяся ткань идентична преформированной ткани. Субституция — замещение повреждённой ткани рубцовой (грубоволокнистой) тканью.
Патологическая регенерация — восстановление повреждённых тканей, при котором ход регенерации нарушен. В зависимости от характера нарушения регенераторного процесса (избыточная регенерация, недостаточная регенерация или образование на месте одной другой, родственной ей ткани) выделяют три формы патологической регенерации: гиперрегенерацию, гипорегенерацию и метаплазию. Гиперрегенерация — образование излишней массы регенерирующей ткани (например, гипертрофический рубец). Гипорегенерация — вялая регенерация, при которой необходимого количества регенерирующей ткани не образуется (например, гипорегенерация тканей в трофических язвах кожи). Метаплазия рассмотрена отдельно.
Внутриклеточная регенерация — обновление и восстановление ультраструктур клетки. Условием внутриклеточной регенерации является обратимость повреждения (паранекротический процесс). В состоянии некробиоза (некрофанероза) внутриклеточная регенерация не возможна. Клеточная регенерация — регенерация ткани за счёт деления и последующего созревания клеток. Условием клеточной регенерации является способность клеток регенерирующей ткани к делению. У взрослого человека способность к активному делению теряют такие клетки, как кардиомиоциты и нейроны. В ходе клеточной регенерации выделяют две фазы: (1) фазу пролиферации, (2) фазу дифференцировки клеток.
Метаплазия[править | править код]
Метаплази́я — замещение одной ткани другой, родственной тканью. Метапластический процесс ограничен рамками одного зародышевого листка: одна эпителиальная ткань меняет другую эпителиальную ткань, один тип соединительной ткани замещается другим типом соединительной ткани. Случаи перехода эпителиальной ткани в соединительную, мышечную или нервную не известны. Возможность метаплазии обусловлена наличием клеток-предшественников, общих для нескольких типов ткани.
Наиболее часто метаплазия встречается в эпителиальных и соединительных тканях:
I. Метаплазия эпителиальных тканей
- Плоскоклеточная метаплазия
- Прозоплазия.
II. Метаплазия соединительных тканей
- Костная метаплазия
- Хрящевая метаплазия.
Самым распространённым вариантом метаплазии является плоскоклеточная метаплазия, при которой на месте однослойного эпителия образуется многослойный плоский эпителий. Так, при хроническом бронхите курильщиков развивается плоскоклеточная метаплазия слизистой оболочки бронхов. Дисплазия такого эпителия может завершиться возникновением плоскоклеточной карциномы лёгкого. Более того, все случаи основного морфологического типа рака лёгкого — плоскоклеточной карциномы — представляют собой результат малигнизации клеток в очагах плоскоклеточной метаплазии бронхов.
Прозоплазия — процесс, обратный плоскоклеточной метаплазии: на месте многослойного плоского эпителия образуется однослойный. Типичным примером прозоплазии служит эндоцервикоз (псевдоэрозия шейки матки), в очагах которой сквамозный эпителий эктоцервикса может трансформироваться в однослойный. Это происходит благодаря камбиальным клеткам эндоцервикального эпителия (их называют резервными), способными к двойной дифференцировке.
Среди форм метаплазии соединительных тканей наиболее часто встречается метаплазия рубцовой (грубоволокнистой) ткани в костную. Например, в зажившем очаге первичного туберкулёза в верхушке лёгкого (очаге Гона) нередко обнаруживается губчатая костная ткань.
Термин «метаплазия» в ряде случаев используется не корректно. Так, «миелоидная метаплазия» (экстрамедуллярный гемопоэз) собственно метаплазией не является, при этом происходит размножение кроветворных клеток в селезёнке, лимфоузлах, в жировой ткани за пределами костного мозга, а не превращение тканей селезёнки, лимфатических узлов или белой жировой ткани в миелоидную, как считали ранее. «Кишечная метаплазия» («энтеролизация») слизистой оболочки желудка (появление в ней слизистых клеток кишечного типа) также является не точным обозначением процесса, т.к. действительной замены желудочного эпителия кишечным в данном случае не происходит. То же можно сказать и о «желудочной метаплазии» («гастролизации») слизистой оболочки кишечника.
Регенерация отдельных видов тканей[править | править код]
Регенерация костной ткани. Регенерирующие ткани, расположенные в области костных отломков, формируют сначала первичную мозоль, затем — окончательную костную мозоль. При неосложнённом переломе регенерацию кости называют первичным костным сращением, при осложнённом — вторичным костным сращением. Первичная мозоль при первичном костном сращении проходит две морфологические стадии: (1) соединительнотканную и (2) костную, в то время как при вторичном сращении первичная мозоль является исключительно костно-хрящевой, что может привести к образованию ложного сустава.
Регенерация мышечных тканей. Обширные повреждения гладкомышечной ткани регенерируют с образованием рубца (субституция). При её незначительном повреждении деление лейомиоцитов приводит к полному закрытию дефекта (реституция). Регенерация скелетной мышечной ткани связана с активностью камбиальных клеток, расположенных под сарколеммой миона (миосателлитоцитов). Клетки-сателлиты при этом делятся и сливаются между собой, образуя в конечном счёте новый мион. В миокарде на месте погибших кардиомиоцитов образуется только рубец (субституция).
Регенерация сосудов. При повреждении стенки крупного сосуда регенерация протекает по типу субституции. Капилляры регенерируют (1) почкованием и (2) аутогенным путём. Почкование характеризуется ответвлением нового капилляра от образованного ранее. Аутогенный механизм заключается в появлении обособленных пролифератов эндотелиальных клеток, формирующих отдельные сосуды, которые затем объединяются между собой.
Регенерация волокнистой ткани. Волокнистая ткань при повреждении регенерирует через стадию грануляционной ткани. Грануляционная ткань ярко-красного цвета, очень мягкая, в дне кожной раны она имеет характерную мелкозернистую поверхность, образованную приподнимающимися капиллярными петлями (отсюда её название: от лат. granula — зёрнышко). При микроскопическом исследовании в грануляционной ткани обнаруживаются многочисленные полнокровные капилляры, окружённые клетками воспалительного инфильтрата. Разрастание грануляционной ткани лежит в основе одной из форм продуктивного воспаления — гранулирующего воспаления. При реституции грануляционная ткань созревает в рыхлую или плотную неоформленную волокнистую ткань, аналогичную преформированной; при субституции — в грубоволокнистую (рубцовую) ткань.
Заживление ран. Выделяют четыре варианта заживления ран:
- Прямая эпителизация при дефектах кожи в пределах эпидермиса
- Заживление первичным натяжением (per primam intentionem) — без нагноения раны
- Заживление вторичным натяжением (per secundam intentionem) — с развитием гнойного воспаления
- Заживление третичным натяжением (per tertiam intentionem) — под образовавшейся коркой (под струпом).
Стресс-синдром[править | править код]
Стресс-синдром — комплекс приспособительных изменений, направленных на мобилизацию энергетических ресурсов организма. Он развивается при физических и психологических нагрузках, а также при различных заболеваниях.
Различают два варианта стресс-синдрома: (1) эустресс — адекватный (физиологический) стресс и (2) дистресс — неадекватный (патологический) стресс.
Стресс-реакция протекает в две стадии — острую и хроническую. Острая стадия обеспечивается в основном катехоламинами (мозговым веществом надпочечников, симпатическими параганглиями), хроническая стадия — глюкокортикоидными гормонами (пучковой зоной коры надпочечников). Поэтому типичными морфологическими проявлениями дистресс-синдрома являются изменения надпочечников (гиперплазия коры и мозгового вещества, при особенно длительном стрессе формируется узелковая гиперплазия коры или аденома коры надпочечников) и аденогипофиза (очаговая или диффузная гиперплазия кортикотропоцитов). Вследствие вторичного гиперкортицизма при дистресс-синдроме формируются различные нарушения в органах и тканях. Особенно ярким среди них является атрофия лимфоидной ткани, обусловливающая иммунодефицитное состояние больных. Глюкокортикоиды в высокой концентрации вызывают апоптоз лимфоцитов, поэтому различные органы иммунной системы уменьшаются (акцидентальная трансформация тимуса, субатрофия лимфатических узлов и белой пульпы селезёнки).
- Давыдовский И. В. Общая патологическая анатомия. 2-е изд.— М., 1969.
- Калитеевский П. Ф. Макроскопическая дифференциальная диагностика патологических процессов.— М., 1987.
- Общая патология человека: Руководство для врачей / Под ред. А. И. Струкова, В. В. Серова, Д. С. Саркисова: В 2 т.— Т. 2.— М., 1990.
- Патологическая анатомия болезней плода и ребёнка / Под ред. Т. Е. Ивановской, Б. С. Гусман: В 2 т.— М., 1981.
- Саркисов Д. С. Очерки по структурным основам гомеостаза.— М., 1977.
- Саркисов Д. С. Регенерация и её клиническое значение.— М., 1970.
- Саркисов Д. С., Аруин Л. И., Туманов В. П. Морфология компенсаторно-приспособительных процессов.— М., 1983.
- Саркисов Д. С., Втюрин Б. В. Электронная микроскопия деструктивных и регенераторных процессов.— М., 1967.
- Саркисов Д. С., Пальцев М. А., Хитров Н. К. Общая патология человека.— М., 1997.
- Струков А. И., Серов В. В. Патологическая анатомия.— М., 1995.
- Тератология человека: Руководство для врачей / Под ред. Г. И. Лазюка.— М., 1991.
определение понятия, сущность и функции
Адаптация организма к агрессивным факторам внешней среды – основной признак, отличающий жизнеспособные бионты. Приспособительные способности включают явления наследственности, онто- и филогенеза, модификационной изменчивости. Роль адаптационных механизмов велика, поскольку недостаточная развитость их приводит к вымиранию целых видов.
Что такое компенсаторный механизм
В общем смысле под таким механизмом понимают выработку рефлекторных реакций и адаптивных изменений в организме в ответ на травмирующие факторы. Это могут быть следствия болезни, агрессивных воздействий среды либо механических повреждений.
Защитно-компенсаторные механизмы вырабатываются для уменьшения повреждающих действий болезни, выступая своеобразной физиологической защитой. Проявляется на всех уровнях: молекулярном, клеточном, тканевом.
К приспособительным реакциям относятся:
- регенерация;
- гипертрофия;
- гиперплазия;
- атрофия;
- метаплазия;
- дисплазия;
- тканевая перестройка;
- организация.
Стоит рассмотреть подробнее виды компенсаторно-приспособительных механизмов и их действие.
Виды компенсаторно-приспособительных реакций
Регенерация – приспособление организма, заключающееся в образовании новых клеток или тканей, взамен отмерших или поврежденных. Восстановление на клеточном уровне предполагает размножение клеток, на внутриклеточном – увеличение клеточных структур.
В зависимости от причин и механизмов регенерация делится на физиологическую (постоянное обновление клеток эпидермиса или слизистых оболочек), репаративно-восстановительную (заживление поврежденных поверхностей) и патологическую (раковые изменения или перерождение тканей).
Гипертрофия и гиперплазия – компенсаторный ответ органа на повышенную нагрузку, проявляется в увеличении размеров клетки в первом случае, либо увеличении количества клеток во втором. Рабочая гипертрофия часто наблюдается в сердечном миокарде при гипертонии, относится к компенсаторным механизмам сердца.
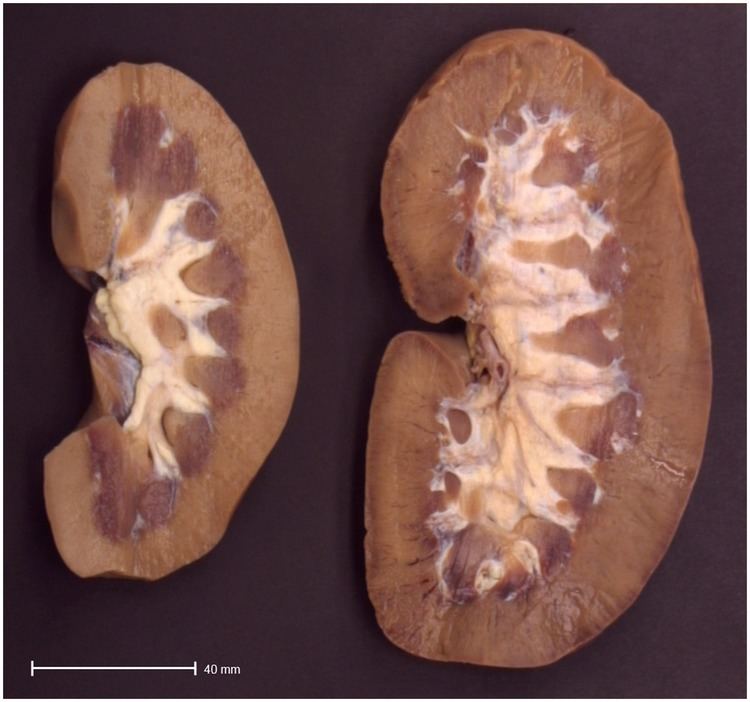
Атрофия – процесс уменьшения размеров и интенсивности функционирования органов и тканей, нагрузка на которые отсутствует длительное время. Так, при параличах нижних конечностей происходит заметное ослабление и уменьшение объема мышечной ткани. Этот механизм связан с рациональным перераспределением трофики клеток: чем меньше энергии требуется на выполнение работы органа или ткани, тем меньше питания к ним поступает.
Метаплазия представляет собой преобразование тканей в родственные виды. Явление характерно для эпителия, в котором происходит переход клеток из призматической формы в плоскую. Наблюдается также в соединительной ткани. Опухолевые новообразования также появляются на фоне метаплазии.
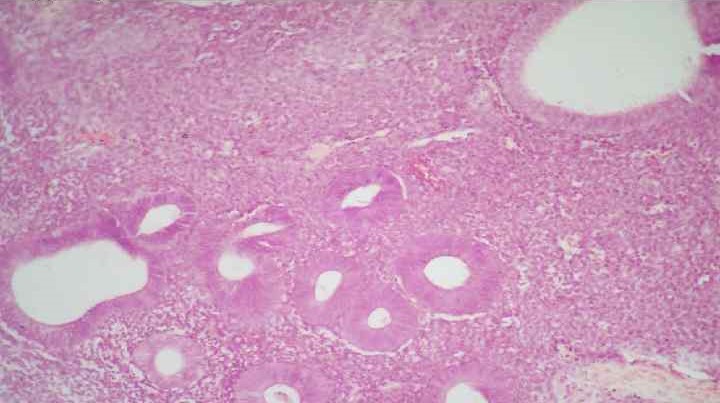
Компенсаторный механизм, при котором развитие клеток, тканей или органов идет по неправильному пути, носит название дисплазия. Выделяют два вида: клеточный и тканевый. Клеточная дисплазия относится к предраковым состояниям и характеризуется изменением форм, размера и строения клетки вследствие нарушения ее дифференциации. Тканевая дисплазия – нарушение структурной организации ткани, органа или его части, развивающаяся в ходе пренатального развития.
Тканевая перестройка – еще одна приспособительная реакция, суть которой заключается в структурных изменениях ткани под воздействием заболеваний. В качестве примера – адаптивная перестройка уплощенного эпителия альвеол, который принимает кубическую форму в условиях недостаточного поступления кислорода.
Организация – заместительная реакция организма, при которой некротизированный или поврежденный участок ткани замещается соединительной тканью. Яркий пример – инкапсуляция и заживление ран.
Фазы защитных компенсаторных процессов
Отличительная черта адаптивных приспособлений – стадийность процессов. Различают три динамические фазы:
- Становление – своего рода аварийная фаза, при которой наблюдается резкий выброс энергии митохондриями клеток органа, несущего увеличенную нагрузку вследствие неблагоприятных условий. Митохондриальная гиперфункция приводит к разрушению крист и последующему энергетическому дефициту – основе этой фазы. В условиях дефицита энергии запускается функциональный резерв организма, и развиваются приспособительные реакции.
- Относительно устойчивая компенсация. Для фазы характерна гиперплазия клеточных структур, усиливающих гипертрофию и гиперплазию клетки в целях снижения энергетического дефицита. В случае, если травмирующий фактор не устранен, большая часть энергии клетки будет постоянно направлена на выдерживание внешней нагрузки в ущерб восстановлению внутриклеточных крист. Это неизбежно повлечет декомпенсацию.
- Декомпенсация, когда наблюдается преобладание процессов распада внутриклеточных структур над их восстановлением. Почти все клетки в подвергшемся патогенезу органе начинают разрушаться, утрачивая способность к репарации. Это происходит оттого, что клетки не получают возможности перестать функционировать, что нужно для нормального восстановления. Вследствие уменьшения нормально функционирующих структур на фоне их постоянной гиперфункции развивается гипоксия тканей, метаболические изменения и, в конечном итоге, дистрофия, вызывающая декомпенсацию.
Развитие компенсаторных реакций – важная часть адаптационного ответа на болезнь. К примеру, функциональные нарушения сердечно-сосудистой системы повлекли появление ряда компенсаторных механизмов организма.
Защитные приспособительные реакции сердца
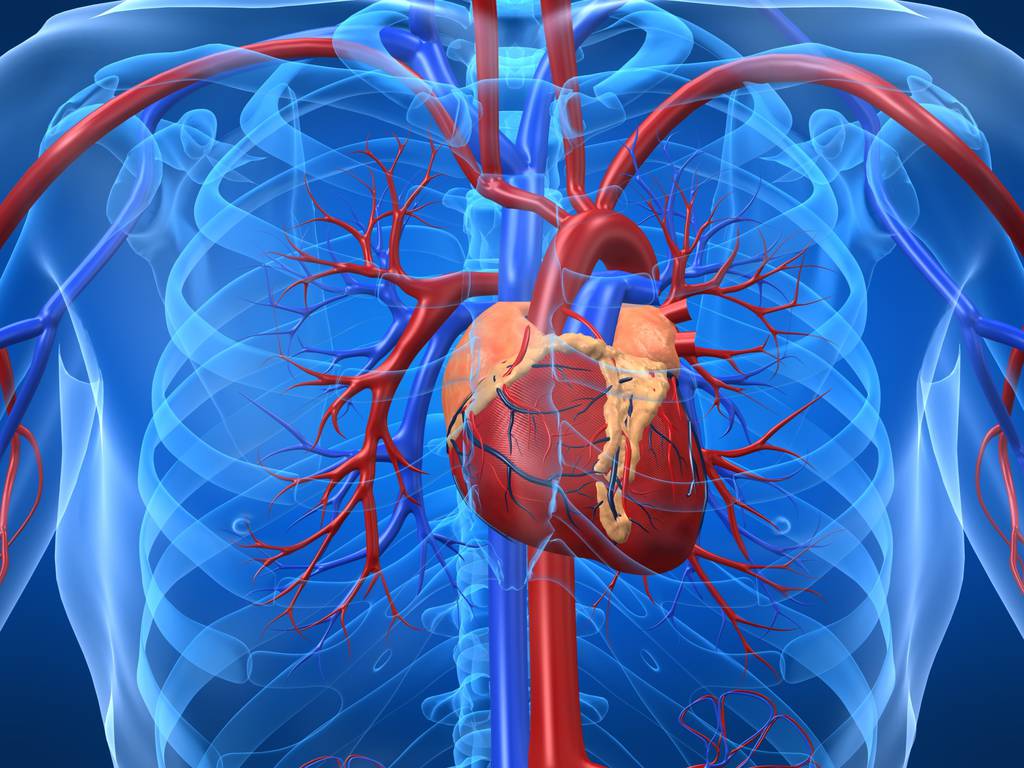
Любые формы ослабления сердца влекут развитие адаптивных процессов, направленных на поддержание кровообращения в организме. Различают три основных вида адаптаций, возникающих непосредственно в сердце:
- объемные изменения сердца, связанные с их тоногенной дилатацией – увеличиваются полости сердца и его ударный объем;
- изменения частоты сердечных сокращений в сторону учащения, вызывающие тахикардию;
- гипертрофические изменения миокарда.
Объемные изменения и тахикардия развиваются быстро в отличие от гипертрофии миокарда, на развитие которого требуется время. При этом увеличивается масса сердечной мышцы. Происходит утолщение стенки в три этапа:
- Аварийный – в ответ на возросшую нагрузку усиливается функционирование структур миокарда, приводящих к нормализации сердечной функции.
- Относительно устойчивая гиперфункция. На этом этапе достигается динамическое равновесие энергообразования миокарда.
- Прогрессирующий кардиосклероз и истощение. Вследствие длительной гиперфункции механическая эффективность работы сердца падает.
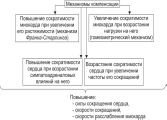
Помимо сердечных механизмов компенсации, различают внесердечные или экстракардиальные, которые включают:
- увеличение объема циркулирующей крови;
- повышение уровня эритроцитов;
- активация ферментов, утилизирующих кислород;
- повышение периферического сопротивления;
- активизация симпатической нервной системы.
Перечисленные компенсаторные механизмы приводят к нормализации кровообращения организма.
Механизмы адаптационной защиты психики
Помимо клеток, тканей и органов адаптационным изменениям подвержена также психика человека. Поскольку увеличение потока перерабатываемой информации, усложнение норм общественной жизни и эмоциональные стрессы значительной степени интенсивности выступают травмирующими факторами, возникают адаптивные процессы психологической защиты. Среди основных компенсаторных механизмов защиты психики выделяют:
- сублимации;
- вытеснения желаний;
- отрицания;
- рационализации;
- инверсии;
- регрессии;
- замещения;
- проекции;
- идентификации;
- интеллектуализации;
- интроекции;
- изоляции.
Эти процессы направлены на снижение или устранение травмирующих факторов, к которым относятся негативные переживания.
Роль компенсаторных процессов в эволюции человека
Эволюционные изменения воспринимаются исследователями следствием выработки адаптивно-компенсаторных реакций. Компенсаторный механизм – основа приспособления организма к изменяющимся условиям среды. Все приспособления направлены на сохранение вида в целом. Поэтому сложно переоценить роль компенсаторных процессов в эволюции видов.
58 Вопрос. Сердечная недостаточность. Этиология. Виды. Компенсаторные механизмы.
Сердечная недостаточность — одна из частных причин утраты трудоспособности, инвалидизации и смерти пациентов, страдающих заболеваниями ССС.
Сердечная недостаточность — не нозологическая форма, не болезнь. Это синдром, развивающийся при многих болезнях, в том числе — поражающих органы и ткани, не относящиеся к ССС.
Сердечная недостаточность — типовая форма патологии, при которой сердце не обеспечивает потребности органов и тканей в адекватном кровоснабжении. Проявляется меньшей величиной сердечного выброса, а также циркуляторной гипоксией.
Сущность сердечной недостаточности заключается в том, что сердце не может переместить в артериальное русло всю кровь, притекающую к нему по венам.
Причины (этиология) сердечной недостаточности
Две основных группы причин приводят к развитию сердечной недостаточности: оказывающие непосредственное повреждающее действие на сердце и обусловливающие функциональную перегрузку сердца,
1. Повреждение сердца. Факторы, непосредственно повреждающие сердце, могут иметь физическую, химическую и биологическую природу.
• Физические факторы: сдавление сердца (экссудатом, кровью, эмфизематозными лёгкими, опухолью), воздействие электрического тока (при электротравме, проведении дефибрилляции сердца), механическая травма (при ушибах грудной клетки, проникающих ранениях, хирургических манипуляциях).
• Химические факторы: нелекарственные химические соединения (например, разобщители окислительного фосфорилирования, соли кальция и тяжёлых металлов, ингибиторы ферментов, гидроперекиси липидов), ЛС в неадекватной дозировке (например, антагонисты кальция, сердечные гликозиды, адреноблокаторы), дефицит кислорода, недостаток химических соединений, необходимых для обмена веществ (например, соли различных металлов).
• Биологические факторы:
† Высокие уровни БАВ (например, катехоламинов, T4).
† Дефицит или отсутствие БАВ, необходимых для метаболизма (например, ферментов, витаминов и др.).
† Длительная ишемия или инфаркт миокарда. Вызывает прекращение сокращений миокарда в зоне повреждения. Это сопровождается функциональной перегрузкой миокарда вне зоны ишемии или инфаркта.
† Кардиомиопатии — поражения миокарда, преимущественно невоспалительной природы. Характеризуются существенными структурно‑функциональными изменениями в сердце.
2. Перегрузка сердца
Причины перегрузки сердца подразделяют на две подгруппы: увеличивающие преднагрузку или увеличивающие посленагрузку.
• Преднагрузка. Увеличение преднагрузки (объём крови, притекающей к сердцу и увеличивающей давление наполнения желудочков) наблюдается при гиперволемии, полицитемии, гемоконцентрации, клапанных пороках (сопровождаются увеличением остаточного объёма крови в желудочках).
• Посленагрузка. Увеличение постнагрузки (сопротивление изгнанию крови из желудочков в аорту и лёгочную артерию, основным фактором постнагрузки является ОПСС) происходит при артериальных гипертензиях любого генеза, стенозах клапанных отверстий сердца, сужении крупных артериальных стволов (аорты, лёгочной артерии).
Виды сердечной недостаточности
Классификация видов сердечной недостаточности основана на критериях происхождения (миокардиальная и перегрузочная), скорости развития (острая и хроническая), преимущественного поражения отдела сердца (левожелудочковая и правожелудочковая), преимущественной недостаточности фазы сердечного цикла (систолическая и диастолическая) и первичности поражения (кардиогенная и некардиогенная).
А) По происхождению
• Миокардиальная форма развивается преимущественно в результате непосредственного повреждения миокарда.
• Перегрузочная форма сердечной недостаточности возникает преимущественно в результате перегрузки сердца (увеличения пред- или постнагрузки).
• Смешанная форма сердечной недостаточности — результат сочетания прямого повреждения миокарда и его перегрузки.
Б) По скорости развития
• Острая (развивается за минуты и часы). Является результатом инфаркта миокарда, острой недостаточности митрального и аортального клапанов, разрыва стенок левого желудочка.
• Хроническая (формируется постепенно, в течение недель, месяцев, годами). Является следствием артериальной гипертензии, хронической дыхательной недостаточности, длительной анемии, пороков сердца. Течение хронической сердечной недостаточности может осложнять острая сердечная недостаточность.
В) По первичности механизма развития
По снижению сократительной функции миокарда или уменьшению притока венозной крови к сердцу выделены первичная (кардиогенная) и вторичная (некардиогенная) формы сердечной недостаточности.
• Первичная (кардиогенная). Развивается в результате преимущественного снижения сократительной функции сердца при близкой к нормальной величине притока венозной крови к нему. Наиболее часто наблюдается при ИБС (может сопровождаться инфарктом миокарда, кардиосклерозом, дистрофией миокарда), миокардитах (например, при воспалительных поражениях мышцы сердца или выраженных и длительных эндотоксинемиях), кардиомиопатиях.
• Вторичная (некардиогенная). Возникает вследствие первичного преимущественного уменьшения венозного притока к сердцу при близкой к нормальной величине сократительной функции миокарда. Наиболее часто встречается при острой массивной кровопотере, нарушении диастолического расслабления сердца и заполнения его камер кровью (например, при сдавлении сердца жидкостью, накапливающейся в полости перикарда — кровью, экссудатом), эпизодах пароксизмальной тахикардии (что приводит к снижению сердечного выброса и возврату венозной крови к сердцу), коллапсе (например, вазодилатационном или гиповолемическом).
Г) По преимущественно поражённому отделу сердца
• Левожелудочковая сердечная недостаточность. Может быть вызвана перегрузкой левого желудочка (например, при стенозе устья аорты) или снижением его сократительной функции (например, при инфаркте миокарда), т.е. состояниями, приводящими к уменьшению выброса крови в большой круг кровообращения, перерастяжению левого предсердия и застою крови в малом круге кровообращения.
• Правожелудочковая сердечная недостаточность. Возникает при механической перегрузке правого желудочка (например, при сужении отверстия клапана лёгочной артерии) или высоком давлении в лёгочной артерии (при лёгочной гипертензии), т.е. состояниях, сопровождающихся уменьшением выброса крови в малый круг кровообращения, перерастяжением правого предсердия и застоем крови в большом круге кровообращения.
• Тотальная. При этой форме выражена и левожелудочковая и правожелудочковая сердечная недостаточность.
Д) По преимущественной недостаточности фазы сердечного цикла
В зависимости от вида нарушения функций миокарда левого желудочка (снижение силы и скорости его сокращения или нарушение скорости расслабления) левожелудочковую сердечную недостаточность подразделяют на систолическую и диастолическую.
• Диастолическая сердечная недостаточность — нарушение расслабления и наполнения левого желудочка. Обусловлена его гипертрофией, фиброзом или инфильтрацией и приводит к увеличению конечного диастолического давления и развитию сердечной недостаточности.
• Систолическая сердечная недостаточность (хроническая) осложняет течение ряда заболеваний. При ней нарушается насосная (нагнетающая) функция сердца, что приводит к уменьшению сердечного выброса.
Компенсаторные механизмы
Механизмы экстренной компенсации сниженной сократительной функции сердца приводит к повышению силы и скорости сокращения сердца, а также скорости расслабления миокарда
Компенсаторная гиперфункция сердца
Функционирование названных выше механизмов обеспечивает экстренную компенсацию сократительной функции перегруженного или повреждённого миокарда. Это сопровождается значительным и более или менее длительным увеличением интенсивности функционирования сердца — его компенсаторной гиперфункцией.
Компенсаторная гипертрофия сердца
Гиперфункция миокарда обусловливает экспрессию отдельных генов кардиомиоцитов. Она проявляется увеличением интенсивности синтеза нуклеиновых кислот и белков. Ускорение синтеза нуклеиновых кислот и белков миокарда приводит к нарастанию его массы — гипертрофии. Биологическое значение компенсаторной гипертрофии сердца заключается в том, что увеличенная функция органа выполняется его возросшей массой.
КОМПЕНСАТОРНЫЙ МЕХАНИЗМ — это… Что такое КОМПЕНСАТОРНЫЙ МЕХАНИЗМ?
- КОМПЕНСАТОРНЫЙ МЕХАНИЗМ
- КОМПЕНСАТОРНЫЙ МЕХАНИЗМ
-
генетич. выравнивающий механизм, направленный на возвращение определенной популяции к исходному состоянию, действующий как реакция на возмущение системы (например, в системе хищник-жертва жертва отвечает на высокое истребление хищником более высокой плодовитостью).
Экологический энциклопедический словарь. — Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989.
.
- КОМПЕНСАТОРНОЕ ПОВЕДЕНИЕ
- КОМПЕНСАЦИОННАЯ ТОЧКА
Смотреть что такое «КОМПЕНСАТОРНЫЙ МЕХАНИЗМ» в других словарях:
Компенсаторный фактор — – механизм, устраняющий отрицательное влияние другого фактора, функции … Словарь терминов по физиологии сельскохозяйственных животных
Выработка условных компенсаторных реакций (conditioning of compensatory reactions) — Когда безусловным раздражителем (БРЗ) является лекарство (включая наркотические средства), условная реакция (УР) зачастую носит характер, противоположный характеру безусловной реакции (БР). Напр., эпинефрин вызывает уменьшение желудочной секреции … Психологическая энциклопедия
Феноптоз — Август Вейсман Феноптоз (гипотеза запрограммированной смерти) выдвинутая в 80 х годах XIX века Августом Вейсманом,[1] … Википедия
Декомпенсация — (от лат. de… приставка, обозначающая отсутствие, и compensatio уравновешивание, возмещение) нарушение нормального функционирования отдельного органа, системы органов или всего организма, наступающее вследствие исчерпания… … Википедия
Биологическая деструкция — Биологические деструктивные процессы разрушение клеток и тканей в ходе жизнедеятельности организма или после его смерти. Эти изменения широко распространены и встречается как в норме, так и в патологии. Биологическая деструкция, наряду с… … Википедия
ФРЕЙД — (Freud) Зигмунд (1856 1939) австр. психолог, невропатолог и психиатр, основоположник психоанализа; представления Ф. о бессознательном, о сублимации, одинамич. психич. структуре личности и мотивах человеч. поведения, значении детского эмоц … Энциклопедия культурологии
БЕССОЗНАТЕЛЬНОЕ — совокупность психических состояний и процессов, которые осуществляются без участия сознания. Концепция Б. была впервые выражена Г. Лейбницем. Он оценивал Б. как низшую форму душевной деятельности. Определенные психические процессы, считал он,… … Философская энциклопедия
Ацидоз — I Ацидоз (acidosis; лат. acidus кислый + ōsis) одна из форм нарушений кислотно щелочного равновесия организма; характеризуется абсолютным или относительным избытком кислот, т.е. веществ, отдающих ионы водорода (протоны), по отношению к основаниям … Медицинская энциклопедия
Термина́льные состоя́ния — (лат. terminalis относящийся к концу, пограничный) состояния, пограничные между жизнью и смертью. К терминальным состояниям относятся умирание, включающее несколько стадий, начальные этапы постреанимационного периода. Умирание представляет собой… … Медицинская энциклопедия
Сексуальный комплекс — это имеющие негативную эмоциональную окраску представления личности (ощущения неудовлетворённости, страха, греха), связанные с половыми отношениями, оказывающие существенное, а иногда и определяющее влияние как на половую жизнь, так и в целом на… … Википедия
Процессы приспособления и компенсации — это… Что такое Процессы приспособления и компенсации?
Приспособление (адапта́ция) к меняющимся условиям существования является наиболее общим свойством живых организмов. Все патологические процессы, по существу, можно разделить на две группы: (1) процессы повреждения (альтеративные процессы) и (2) процессы приспособления (адаптивные процессы).
Механизмы приспособления
К механизмам, обеспечивающим приспособление, относятся специальные защитные системы, регуляция функций организма и избегающее поведение.
I. Специальные защитные системы, препятствующие наиболее разрушительным внешним воздействиям
- Иммунная система и система мононуклеарных фагоцитов как защита от генетически чужеродной экспансии
- Механизм воспаления и тесно связанный с ним феномен репаративной регенерации как универсальные способы восстановления повреждённых тканей
- Система антибластомной резистентности, препятствующая возникновению незрелых злокачественных опухолей
- Свёртывание крови (гемокоагуляция, тромбоз) как защита от потери внутрисосудистой жидкой ткани
- Стресс-система, обеспечивающая развитие стресс-синдрома.
II. Механизмы регуляции всех функций организма.
III. Избегающее поведение (его формирует ноцицептивная система).
Стадии адаптогенеза
Выделяют три стадии в развитии адаптивного процесса:
- Рецепция адаптогена (адаптогенного стимула) — восприятие изменения какого-либо параметра среды
- Регуляция адаптогенеза (настройка силы и длительности адаптивного ответа)
- Адаптивный ответ (адаптивная реакция) — изменение характера функционирования организма или его отдельных структур, соответствующее изменившимся внешним условиям.
Формы адаптации
Приспособительные реакции подразделяют на (1) ортоадаптивные, (2) дизадаптивные и (3) компенсаторные.
I. Ортоадаптация (адекватная адаптация) — приспособление организма, соразмерное силе и характеру адаптогена.
II. Дизадаптация (патологическая адаптация) — неадекватная приспособительная реакция
- Гиперадаптация — избыточный адаптивный ответ (аллергия; дистресс-синдром; фибринозное, геморрагическое и гнойное воспаление; гиперрегенерация)
- Гипоадаптация — недостаточность адаптогенеза (иммунодефицит, гипорегенерация)
- Анадаптация — неспособность к адаптивному ответу (крайняя степень гипоадаптации)
- Дезадаптация — срыв адаптации.
III. Компенсация (компенсаторные, или эксквизитные, реакции).
Дезадаптация (срыв адаптации) является вариантом анадаптивных состояний (приобретённая анадаптация). Дезадаптация представляет собой достижение предела адаптации для данного организма.
Исходами дезадаптации являются:
- Смерть организма при необратимой дезадаптации
- Реадаптация (восстановление приспособительных возможностей) при обратимой дезадаптации.
Аналогичные дезадаптации и реадаптации состояния в случае компенсаторных процессов обозначаются терминами «декомпенсация» и «рекомпенсация» соответственно.
Компенсаторные процессы
Компенсация (компенсаторные процессы) — адаптация в условиях болезни, приспособление к патологическим условиям существования организма. Сформированное таким образом приспособление (стадия компенсации) рано или поздно завершается истощением функциональных возможностей и срывом компенсации — декомпенсацией (стадия декомпенсации). При декомпенсации жизненно важных функций наступает смерть организма. Рекомпенсация возможна только путём замены «изношенного» органа полноценным донорским (трансплантация органа). Таким образом, решение проблемы рекомпенсации зависит от успехов трансплантационной медицины.
Морфология приспособительных процессов
В отечественной патологической анатомии среди приспособительных процессов, помимо воспаления, иммунного ответа и тромбоза, традиционно рассматривают объёмные процессы (атрофию и гипертрофию), регенерацию, дисплазию, организацию и стресс-синдром.
Объёмные процессы
К объёмным процессам относят атрофию («негативный объёмный процесс») и гипертрофию («позитивный объёмный процесс»). Своеобразным вариантом гипертрофии является гиперплазия.
Гипертрофия и гиперплазия
Гипертрофи́я — увеличение объёма какой-либо биологической структуры (органа, ткани, клетки, органеллы). Исключением является организм в целом: не принято говорить о гипертрофии всего тела человека. Гипертрофия может быть врождённым процессом. Гиперплази́я — гипертрофия ткани за счёт увеличения количества образующих её клеток, т.е. в результате их активного деления. Гиперплазия — один из вариантов разрастания тканей (другой вариант — опухоль). В отличие от гиперплазии, опухолевый рост не является приспособительным процессом. Гипертрофия не всегда относится к патологическим процессам, в ряде случаев (нейрогуморальная гипертрофия) она носит физиологический характер.
Варианты гипертрофии классифицируют следующим образом:
I. Приспособительные (адаптивные) варианты
- Нейрогуморальная гипертрофия (физиологическая и патологическая)
- Гипертрофические разрастания.
II. Компенсаторные варианты
- Рабочая гипертрофия
- Викарная (заместительная) гипертрофия.
- Регенераторная гипертрофия.
III. Врождённая гипертрофия.
Нейрогуморальная гипертрофия — гипертрофия, развивающаяся под влиянием гормонов, стимулирующих деление клеток. Выделяют (1) физиологические и (2) патологические варианты нейрогуморальной гипертрофии. Примером физиологической нейрогуморальной гипертрофии является увеличение матки при беременности и молочных желёз при лактации. К патологической нейрогуморальной гипертрофии относятся гиперплазия эндометрия, нодулярная гиперплазия простаты, увеличение органов при синдромах гиперпродукции соматотропного гормона (гигантизме и акромегалии) и т.п.
Гипертрофические разрастания — разрастания тканей при нарушениях крово- и лимфообращения (фиброз), а также на фоне хронического воспаления (фиброэпителиальные и гиперпластические полипы). [Аденоматозные полипы, в отличие от гиперпластических и фиброэпителиальных, являются доброкачественными опухолями, разновидностью аденом.]
Рабочая гипертрофия — гипертрофия гиперфункционирующего органа. Типичным примером рабочей гипертрофии служит гипертрофия миокарда левого желудочка при длительной артериальной гипертензии.
Викарная гипертрофия — гипертрофия одного из парных органов при отсутствии (аплазия, хирургическое удаление), недоразвитии (врождённой гипоплазии) или приобретённой гипофункции другого. Наиболее характерна викарная гипертрофия почки. Викарную гипертрофию можно рассматривать как разновидность рабочей гипертрофии.
Регенераторная гипертрофия — гипертрофия паренхиматозных клеток органа вокруг рубца при субституции. Так, при инфаркте миокарда по периферии сформированного пост-инфарктного рубца сохранные кардиомиоциты существенно увеличиваются, тем самым частично компенсируя функцию погибших клеток. Регенераторная гипертрофия также является своеобразным вариантом рабочей гипертрофии.
Врождённая гипертрофия — один из видов пороков развития органов (например, врождённая гипертрофия больших слюнных желёз).
Атрофия
Атрофи́я — уменьшение объёма какой-либо биологической структуры (органа, ткани, клетки, органеллы) или организма в целом. Для того, чтобы произошло уменьшение объёма структуры, она должна быть соответствующим образом развита, поэтому атрофию необходимо отличать от врождённой гипоплазии (недоразвития органа). Следовательно, атрофия всегда является приобретённым процессом.
Атрофию подразделяют на местную и общую, физиологическую и патологическую.
I. Общая физиологическая атрофия.
II. Местная физиологическая атрофия (инволюция).
III. Общая патологическая атрофия (кахексия).
IV. Местная патологическая атрофия
- Дисфункциональная атрофия (атрофия от бездействия)
- Прессогенная атрофия (атрофия от давления)
- Нейротическая (нейролитическая) атрофия
- Атрофия при хроническом нарушении кровообращения
- Атрофия при действии химических и физических факторов
- Псевдогипертрофия.
Общая физиологическая атрофия развивается в старости: уменьшаются отдельные органы и организм в целом.
Инволюция («обратное развитие органов») также относится к атрофическим процессам физиологического характера, например, возрастная инволюция тимуса, пост-гравидарная инволюция эндометрия и т.п.
Кахексия (истощение, маразм) развивается при длительном полном голодании (алиментарная кахексия), хронических инфекционных заболеваниях (например, при туберкулёзе), злокачественных опухолях («раковая кахексия»), при тяжёлой гипофункции аденогипофиза («гипофизарная кахексия»), гипоталамуса («церебральная кахексия»). Для истощения характерна бурая атрофия миокарда и печени.
Дисфункциональная атрофия — атрофия гипофункционирующего органа (например, атрофические процессы в скелетных мышцах при длительной иммобилизации конечности).
Прессогенная атрофия — атрофия, вызванная длительным сдавлением органа или его части. Типичными примерами прессогенной атрофии являются атрофия мозга при гидроцефалии и атрофия почки при гидронефрозе. В первом случае ткань головного мозга сдавлена блокированным в желудочках ликвором, во втором — на ткань почки оказывает давление моча, переполняющая чашечно-лоханочную систему органа при нарушении её оттока.
Нейротическая атрофия — атрофия денервированной ткани. Правильно называть данный процесс «нейролитической артрофией», однако слог «-ли-» по какой-то причине выпал и термин стали использовать в усечённом варианте. Нейротическую атрофию можно рассматривать как разновидность дисфункциональной атрофии, т.к. функция денервированной ткани снижается или полностью выпадает.
Атрофия при хроническом нарушении кровообращения (хронической ишемии и хроническом застойном полнокровии) проявляется уменьшением объёма паренхимы органа, в то время как строма может подвергаться гипертрофии за счёт фиброза.
Атрофия при действии химических и физических факторов. Различные факторы химической и физической природы способны вызывать атрофический процесс. Так, ионизирующее излучение приводит к атрофии ткани красного костного мозга (радиогенная атрофия миелоидной ткани), длительное применение в больших дозах глюкокортикоидных гормонов способствует развитию атрофии пучковой зоны коры надпочечников и т.п.
Псевдогипертрофия — атрофия паренхимы при одновременной гипертрофии стромы органа. Данный процесс относится к вариантам атрофии, т.к. при этом функция органа снижается. Гипертрофия стромы может развиваться за счёт фиброза (например, при гипертрофическом циррозе печени) или липоматоза (например, так называемое вакатное ожирение скелетных мышц).
Организация
Организацией в отечественной патологической анатомии называют четыре формы фиброза:
- Организация детрита — замещение волокнистой тканью некротических масс
- Организация тромботических масс (организация тромба)
- Организация фибринозного экссудата
- Инкапсуляция — обрастание фиброзной тканью детрита, инородных тел или погибших паразитов с формированием соединительнотканной капсулы.
Дисплазия
Дисплази́я — нарушение дифференцировки (созревания) тканей и клеток.
Классификация
Различают дисплазию тканей и дисплазию клеток.
I. Дисплазия ткани
- Врождённая тканевая дисплазия
- Постнатальная тканевая дисплазия.
Варианты врождённой тканевой дисплазии
- Персисте́нция эмбриональных структур
- Гама́ртия
- Хори́стия (врождённая гетеротопи́я).
II. Дисплазия клеток
- Дисплазия I степени (интраэпителиальная неоплазия I степени)
- Дисплазия II степени (интраэпителиальная неоплазия II степени)
- Дисплазия III степени (вместе с карциномой in situ обозначается термином «интраэпителиальная неоплазия III степени»).
Тканевая дисплазия
Тканевая дисплазия — нарушение нормального соотношения элементов в ткани или появление структур, не встречающихся в норме.
Тканевая дисплазия может быть (1) врождённой или (2) развивается в постнатальном онтогенезе. Типичным примером постнатальной тканевой дисплазии является доброкачественная дисплазия молочной железы (фиброзно-кистозная болезнь, мастопатия), при которой в ткани молочной железы увеличивается пропорция эпителиальных клеток («пролиферативная форма») или стромы («непролиферативная форма»). При дисплазии тимуса обычно увеличено количество эпителиальных клеток и снижено число тимоцитов.
Врождённая тканевая дисплазия проявляется тремя типами изменений: (1) персистенцией эмбриональных структур, формированием (2) гамартий и (3) хористий. Эмбриональные структуры (карман Ратке, жаберные щели, хорда и т.п.) в определённые сроки антенатального онтогенеза должны подвергаться инволюции. Если этого не происходит, их существование затягивается (эмбриональные структуры персистируют), т.е. в ткани остаются элементы, которых уже быть не должно. Гама́ртией называется избыточно развитый нормальный компонент ткани (например, кровеносные сосуды в ткани врождённых гемангиом, меланоциты в невусах). Хори́стия (врождённая гетеротопи́я) — появление в созревшей ткани нехарактерных для неё структур (например, ткани слюнных желёз в челюстных костях или панкреатической ткани в стенке желудка). Персистирующие эмбриональные структуры, гамартии и хористии могут служить источником развития опухолей (прогономы, гамартомы, хористомы), в том числе злокачественных.
Клеточная дисплазия
Дисплазия клеток — предраковый процесс, характеризующийся появлением признаков клеточного атипизма.
Выраженность клеточной дисплазии различная. Ранее выделяли три степени дисплазии клеток (лёгкая, умеренная и тяжёлая), в настоящее время часто ограничиваются двумя крайними степенями (low grade и high grade). Клеточная дисплазия особенно детально изучена для эпителиоцитов разных органов. В последние два десятилетия термин «клеточная дисплазия» (также как и термин «карцинома in situ») в патологоанатомической и онкологической практике заменён термином «интраэпителиальная неоплазия». При этом в рубрику «тяжёлой интраэпителиальной неоплазии» (III степени) включена тяжёлая дисплазия клеток (дисплазия III степени) и карцинома in situ. Тяжёлая форма клеточной дисплазии относится к облигатному предраку.
Регенерация
Регенера́ция — обновление и восстановление тканей.
Классификация
Формы регенерации классифицируют следующим образом:
I. Характер процесса
- Физиологическая регенерация
- Репаративная регенерация (репарация)
- Патологическая регенерация.
Формы репарации:
- Реституция
- Субституция.
Формы патологической регенерации:
- Гиперрегенерация
- Гипорегенерация
- Метаплазия.
II. Особенности восстановления клеток
- Внутриклеточная регенерация
- Клеточная регенерация.
Физиологическая регенерация — обновление тканей. Физиологическая регенерация протекает постоянно во всех тканях организма, но с разной скоростью. Наиболее быстро обновляется миелоидная и лимфоидная ткань, а также эпителиальная выстилка желудка и кишечника. Очень медленное обновление происходит в скелетных (костной и хрящевой) тканях.
Регенерацию повреждённых тканей (т.е. их восстановление) подразделяют на репаративную и патологическую. Репаративная регенерация (репарация) — восстановление повреждённых тканей, при котором процесс регенерации протекает нормально, хотя и быстрее физиологической регенерации. Различают две формы репарации: реституцию и субституцию. Реституция — полное восстановление повреждённой ткани. Образовавшаяся ткань идентична преформированной ткани. Субституция — замещение повреждённой ткани рубцовой (грубоволокнистой) тканью.
Патологическая регенерация — восстановление повреждённых тканей, при котором ход регенерации нарушен. В зависимости от характера нарушения регенераторного процесса (избыточная регенерация, недостаточная регенерация или образование на месте одной другой, родственной ей ткани) выделяют три формы патологической регенерации: гиперрегенерацию, гипорегенерацию и метаплазию. Гиперрегенерация — образование излишней массы регенерирующей ткани (например, гипертрофический рубец). Гипорегенерация — вялая регенерация, при которой необходимого количества регенерирующей ткани не образуется (например, гипорегенерация тканей в трофических язвах кожи). Метаплазия рассмотрена отдельно.
Внутриклеточная регенерация — обновление и восстановление ультраструктур клетки. Условием внутриклеточной регенерации является обратимость повреждения (паранекротический процесс). В состоянии некробиоза (некрофанероза) внутриклеточная регенерация не возможна. Клеточная регенерация — регенерация ткани за счёт деления и последующего созревания клеток. Условием клеточной регенерации является способность клеток регенерирующей ткани к делению. У взрослого человека способность к активному делению теряют такие клетки, как кардиомиоциты и нейроны. В ходе клеточной регенерации выделяют две фазы: (1) фазу пролиферации, (2) фазу дифференцировки клеток.
Метаплазия
Метаплази́я — замещение одной ткани другой, родственной тканью. Метапластический процесс ограничен рамками одного зародышевого листка: одна эпителиальная ткань меняет другую эпителиальную ткань, один тип соединительной ткани замещается другим типом соединительной ткани. Случаи перехода эпителиальной ткани в соединительную, мышечную или нервную не известны. Возможность метаплазии обусловлена наличием клеток-предшественников, общих для нескольких типов ткани.
Наиболее часто метаплазия встречается в эпителиальных и соединительных тканях:
I. Метаплазия эпителиальных тканей
- Плоскоклеточная метаплазия
- Прозоплазия.
II. Метаплазия соединительных тканей
- Костная метаплазия
- Хрящевая метаплазия.
Самым распространённым вариантом метаплазии является плоскоклеточная метаплазия, при которой на месте однослойного эпителия образуется многослойный плоский эпителий. Так, при хроническом бронхите курильщиков развивается плоскоклеточная метаплазия слизистой оболочки бронхов. Дисплазия такого эпителия может завершиться возникновением плоскоклеточной карциномы лёгкого. Более того, все случаи основного морфологического типа рака лёгкого — плоскоклеточной карциномы — представляют собой результат малигнизации клеток в очагах плоскоклеточной метаплазии бронхов.
Прозоплазия — процесс, обратный плоскоклеточной метаплазии: на месте многослойного плоского эпителия образуется однослойный. Типичным примером прозоплазии служит эндоцервикоз (псевдоэрозия шейки матки), в очагах которой сквамозный эпителий эктоцервикса может трансформироваться в однослойный. Это происходит благодаря камбиальным клеткам эндоцервикального эпителия (их называют резервными), способными к двойной дифференцировке.
Среди форм метаплазии соединительных тканей наиболее часто встречается метаплазия рубцовой (грубоволокнистой) ткани в костную. Например, в зажившем очаге первичного туберкулёза в верхушке лёгкого (очаге Гона) нередко обнаруживается губчатая костная ткань.
Термин «метаплазия» в ряде случаев используется не корректно. Так, «миелоидная метаплазия» (экстрамедуллярный гемопоэз) собственно метаплазией не является, при этом происходит размножение кроветворных клеток в селезёнке, лимфоузлах, в жировой ткани за пределами костного мозга, а не превращение тканей селезёнки, лимфатических узлов или белой жировой ткани в миелоидную, как считали ранее. «Кишечная метаплазия» («энтеролизация») слизистой оболочки желудка (появление в ней слизистых клеток кишечного типа) также является не точным обозначением процесса, т.к. действительной замены желудочного эпителия кишечным в данном случае не происходит. То же можно сказать и о «желудочной метаплазии» («гастролизации») слизистой оболочки кишечника.
Регенерация отдельных видов тканей
Регенерация костной ткани. Регенерирующие ткани, расположенные в области костных отломков, формируют сначала первичную мозоль, затем — окончательную костную мозоль. При неосложнённом переломе регенерацию кости называют первичным костным сращением, при осложнённом — вторичным костным сращением. Первичная мозоль при первичном костном сращении проходит две морфологические стадии: (1) соединительнотканную и (2) костную, в то время как при вторичном сращении первичная мозоль является исключительно костно-хрящевой, что может привести к образованию ложного сустава.
Регенерация мышечных тканей. Обширные повреждения гладкомышечной ткани регенерируют с образованием рубца (субституция). При её незначительном повреждении деление лейомиоцитов приводит к полному закрытию дефекта (реституция). Регенерация скелетной мышечной ткани связана с активностью камбиальных клеток, расположенных под сарколеммой миона (миосателлитоцитов). Клетки-сателлиты при этом делятся и сливаются между собой, образуя в конечном счёте новый мион. В миокарде на месте погибших кардиомиоцитов образуется только рубец (субституция).
Регенерация сосудов. При повреждении стенки крупного сосуда регенерация протекает по типу субституции. Капилляры регенерируют (1) почкованием и (2) аутогенным путём. Почкование характеризуется ответвлением нового капилляра от образованного ранее. Аутогенный механизм заключается в появлении обособленных пролифератов эндотелиальных клеток, формирующих отдельные сосуды, которые затем объединяются между собой.
Регенерация волокнистой ткани. Волокнистая ткань при повреждении регенерирует через стадию грануляционной ткани. Грануляционная ткань ярко-красного цвета, очень мягкая, в дне кожной раны она имеет характерную мелкозернистую поверхность, образованную приподнимающимися капиллярными петлями (отсюда её название: от лат. granula — зёрнышко). При микроскопическом исследовании в грануляционной ткани обнаруживаются многочисленные полнокровные капилляры, окружённые клетками воспалительного инфильтрата. Разрастание грануляционной ткани лежит в основе одной из форм продуктивного воспаления — гранулирующего воспаления. При реституции грануляционная ткань созревает в рыхлую или плотную неоформленную волокнистую ткань, аналогичную преформированной; при субституции — в грубоволокнистую (рубцовую) ткань.
Заживление ран. Выделяют четыре варианта заживления ран:
- Прямая эпителизация при дефектах кожи в пределах эпидермиса
- Заживление первичным натяжением (per primam intentionem) — без нагноения раны
- Заживление вторичным натяжением (per secundam intentionem) — с развитием гнойного воспаления
- Заживление третичным натяжением (per tertiam intentionem) — под образовавшейся коркой (под струпом).
Стресс-синдром
Стресс-синдром — комплекс приспособительных изменений, направленных на мобилизацию энергетических ресурсов организма. Он развивается при физических и психологических нагрузках, а также при различных заболеваниях.
Различают два варианта стресс-синдрома: (1) эустресс — адекватный (физиологический) стресс и (2) дистресс — неадекватный (патологический) стресс.
Стресс-реакция протекает в две стадии — острую и хроническую. Острая стадия обеспечивается в основном катехоламинами (мозговым веществом надпочечников, симпатическими параганглиями), хроническая стадия — глюкокортикоидными гормонами (пучковой зоной коры надпочечников). Поэтому типичными морфологическими проявлениями дистресс-синдрома являются изменения надпочечников (гиперплазия коры и мозгового вещества, при особенно длительном стрессе формируется узелковая гиперплазия коры или аденома коры надпочечников) и аденогипофиза (очаговая или диффузная гиперплазия кортикотропоцитов). Вследствие вторичного гиперкортицизма при дистресс-синдроме формируются различные нарушения в органах и тканях. Особенно ярким среди них является атрофия лимфоидной ткани, обусловливающая иммунодефицитное состояние больных. Глюкокортикоиды в высокой концентрации вызывают апоптоз лимфоцитов, поэтому различные органы иммунной системы уменьшаются (акцидентальная трансформация тимуса, субатрофия лимфатических узлов и белой пульпы селезёнки).
См. также
Литература
- Давыдовский И. В. Общая патологическая анатомия. 2-е изд.— М., 1969.
- Калитеевский П. Ф. Макроскопическая дифференциальная диагностика патологических процессов.— М., 1987.
- Общая патология человека: Руководство для врачей / Под ред. А. И. Струкова, В. В. Серова, Д. С. Саркисова: В 2 т.— Т. 2.— М., 1990.
- Патологическая анатомия болезней плода и ребёнка / Под ред. Т. Е. Ивановской, Б. С. Гусман: В 2 т.— М., 1981.
- Саркисов Д. С. Очерки по структурным основам гомеостаза.— М., 1977.
- Саркисов Д. С. Регенерация и её клиническое значение.— М., 1970.
- Саркисов Д. С., Аруин Л. И., Туманов В. П. Морфология компенсаторно-приспособительных процессов.— М., 1983.
- Саркисов Д. С., Втюрин Б. В. Электронная микроскопия деструктивных и регенераторных процессов.— М., 1967.
- Саркисов Д. С., Пальцев М. А., Хитров Н. К. Общая патология человека.— М., 1997.
- Струков А. И., Серов В. В. Патологическая анатомия.— М., 1995.
- Тератология человека: Руководство для врачей / Под ред. Г. И. Лазюка.— М., 1991.
67.Компенсаторные механизмы
Вследствие истечения крови из сосудистого русла в организме больного развивается гиповолемия — снижение объема циркулирующей жидкости. В ответ на это в организме больного включаются определенные компенсаторно-приспособительные механизмы: — веноспазм; — приток тканевой жидкости; — тахикардия; — олигурия; — гипервентиляция; — периферический артериолоспазм.
Механизм сосудистых изменений связан с рефлекторной реакцией, начинающейся с волюмо-, баро- и хеморецепторов сосудов. Большую роль при этом играет стимуляция симпато-адреналовой системы. Раздражение волюморецепторов сердца и крупных сосудов приводит к активации структур гипоталамуса, а затем гипофиза и надпочечников.
Система активации симпато-адреналовой системы рис.
ОПС — общее периферическое сопротивление; УОС — ударный объем сердца; МОК — минутный объем кровообращения; ОЦП — объем циркулирующей плазмы; ОЦЭ — объем циркулирующих эритроцитов
Влияние симпато-адреналовой системы приводит к уже названным выше компенсаторно-приспособительным изменениям в организме.
Веноспазм Вены — основная емкостная часть сосудистого русла, в них находится 70-75% циркулирующей крови. Развивающийся при кровопотере веномоторный эффект (повышение тонуса вен) компенсирует потерю ОЦК до 10-15%. При этом венозный возврат к сердцу практически не страдает.
Приток тканевой жидкости
Вследствие гиповолемии, а также из-за развивающегося впоследствии симптома малого сердечного выброса и спазма артериол снижается гидростатическое давление в капиллярах, что приводит к переходу в них межклеточной жидкости. Такой механизм в первые 5 минут при кровопотере может обеспечить приток в сосуды до 10-15% ОЦК. Таким образом развивается гемодилюция, следующая за короткой гемоконцентрацией.
Основными показателями степени гемодилюции являются удельный вес крови, гематокрит, уровень гемоглобина и количество эритроцитов. Именно эти показатели используются в клинике при оценке объема и тяжести кровопотери.
Развивающаяся при острой кровопотере аутогемодилюция оказывает следующие эффекты: — компенсирует гиповолемию, — улучшает реологические свойства крови, — способствует вымыванию из депо эритроцитов и восстанавливает кислородную емкость крови.
К физиологическим депо организма относятся нефункционирующие капилляры (90% всех капилляров), в основном это капиллярная сеть мышечной ткани скелетной мускулатуры, а также печень (депонируется до 20% ОЦК) и селезенка (до 16% ОЦК).
При острой кровопотере транскапиллярное перемещение жидкости может достичь 1/2-1/3 объема внеклеточной жидкости, т. е. 4-7 литров (по данным Г. А. Рябова (1984г.) объем внеклеточной жидкости составляет около 20% массы тела).
По составу межклеточная жидкость отличается от крови отсутствием форменных элементов и низким содержанием белков. Поэтому, несмотря на быстрое восстановление объема циркулирующей крови, качественный ее состав восстанавливается постепенно.
Сроки компенсации объема кровопотери
Изучаемый объем Время восполнения Объем крови 24-48 часов Объем плазмы 24-48 часов Концентрация белков плазмы: — максимальное разжижение 2 часа — восстановление до исходного уровня 48-72 часов — восстановление нормального состава 72-96 часов Масса эритроцитов 20-25 суток
Тахикардия
Развитие гиповолемии приводит к снижению венозного притока к сердцу и, соответственно, сердечного выброса. Развивающаяся тахикардия, связанная с воздействием симпато-адреналовой системы, определенное время позволяет поддерживать минутный сердечный объем на нормальном уровне.
Олигурия
При гиповолемии происходит стимуляция секреции антидиуретического гормона гипофиза и альдостерона. Это приводит к увеличению реабсорбции воды, задержке ионов натрия и хлоридов. Развивается олигурия.
Гипервентиляция
Вначале приспособительная гипервентиляция направлена на увеличение присасывающего действия грудной клетки и компенсаторное увеличение притока крови к сердцу. Затем ее развитие во многом связано с метаболическими изменениям в органах и тканях и нарушением кислотно-щелочного равновесия.
Периферический артериолоспазм
По существу спазм периферических артерий — переходный этап между компенсаторными и патологическими реакциями при кровопотере, важнейший механизм поддержания системного артериального давления и кровоснабжения головного мозга, сердца и легких.
В тех случаях, когда указанные компенсаторные механизмы достаточны для поддержания нормального ОЦК и кровотечение останавливается, постепенно нормализуется состояние всех органов и систем. Если объем кровопотери превосходит компенсаторные возможности организма, развивается комплекс патологических расстройств.
