Люди с отрицательным резус-фактором крови — особенные. И вот почему
Известный американский исследователь паранормальных явлений Брэд Стайгер подметил интересную особенность: люди, имеющие отрицательный резус-фактор крови, не совсем обычные…
Если точнее, он предположил, что эти люди — либо из особой генетической линии «Homo sapiens», либо потомки инопланетян
Дело в том, что, согласно законам генетики, мы можем наследовать только те свойства, какими обладали наши предки, если речь, конечно, не идет о мутации. А это значит, что если человек и обезьяна произошли от одного пращура, то их кровь должна быть совместимой.
Однако у всех приматов резус-фактор положительный… Вот вообще у всех!
Откуда же у некоторых людей отрицательный резус-фактор? Получается, такие люди – потомки какого-то другого предка. Быть может, пришельцев?
Еще подмечено, что самый высокий процент носителей отрицательного резус-фактора – 30% – среди испанских басков (происхождение которых, кстати, – до сих пор загадка), израильских евреев восточного происхождения, самаритян и эфиопских черных евреев.
В то время как у других народов количество таких людей едва достигает 1%.
Большинство медиумов, знахарей, людей с необычными психическими способностями также имеют отрицательный резус-фактор.
Как мы знаем, есть всего 4 группы крови. Все они отличаются по составу, а если точнее — по наличию различных белков в клетках крови, которые борются с бактериями в организме. У большинства людей эти белки есть, и они являются резус-положительными.
Почему у некоторых людей этих белков нет — загадка! Ученые считают, что первые люди на Земле с отрицательным резус-фактором появились 35 000 лет назад.
Вот некоторые общие характеристики для людей с отрицательным резус-фактором:
-
Они имеютболее высокий, чем у «положительных» людей, IQ;
-
Обычно у них болеенизкая, чем у остальных,температура тела;
-
Психически и эмоционально эти людигораздо более устойчивы;
-
Они часто имеютрыжие волосы;
-
Они оченьчувствительны к теплуи не любят холод.

-
Чаще всего у нихголубые, зеленые или светло-карие глаза.
Еще один любопытный феномен этих людей связан с беременностью.
Известно, что клонировать людей с отрицательным резус-фактором нельзя.
Более того, если беременная мать имеет отрицательный резус, иммунная система ее тела будет атаковать плод, воспринимая его как инородное тело. Вот почему таких женщин врачи просят принимать специальные лекарства во время беременности, которые подавляют иммунитет.
Но почему их собственное тело атакует собственных детей, т.е. почему оно воспринимает их как «чужих«? У этой загадки нет ответа, но она определенно работает в пользу теории об «инопланетном» происхождении таких людей.
Кстати, археологи нашли огромное количество древних текстов и произведений искусства, которые описывают странных существ, посещавших планету.
Тайна вел-отрицательной группы крови разгадана | Научные открытия и технические новинки из Германии | DW
Эритроциты, они же красные кровяные тельца — это высокоспециализированные клетки крови, содержащие гемоглобин и благодаря этому выполняющие одну жизненно-важную функцию: перенос кислорода из легких к прочим органам и тканям и перенос углекислого газа в обратном направлении.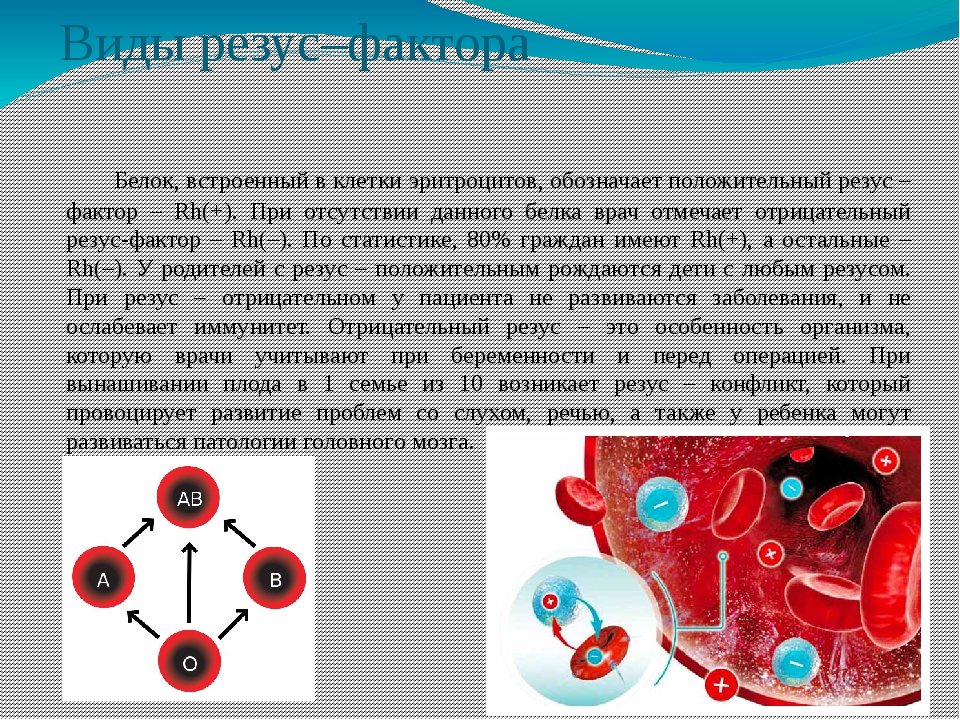 То, что особенности именно этих клеток определяют группу крови человека, знает сегодня каждый. А вот то, что систем групп крови существует свыше 30, известно, пожалуй, лишь специалистам. К наиболее распространенным относится система АВ0 и резус-система, но этим дело отнюдь не исчерпывается, потому что в мембране эритроцитов содержится три с лишним сотни различных антигенных факторов, которые при переливании крови могут — в случае несовместимости — вызвать у реципиента иммунный ответ и, как следствие, серьезные осложнения.
То, что особенности именно этих клеток определяют группу крови человека, знает сегодня каждый. А вот то, что систем групп крови существует свыше 30, известно, пожалуй, лишь специалистам. К наиболее распространенным относится система АВ0 и резус-система, но этим дело отнюдь не исчерпывается, потому что в мембране эритроцитов содержится три с лишним сотни различных антигенных факторов, которые при переливании крови могут — в случае несовместимости — вызвать у реципиента иммунный ответ и, как следствие, серьезные осложнения.
Загадочный случай миссис Вел
Поэтому в трансфузиологии учитывают сегодня и значительно более редкие антигенные детерминанты, нежели традиционные факторы АВ0 и резус-фактор. Проблема лишь в том, что далеко не все эти детерминанты изучены. В частности, долгое время оставалась загадкой так называемая вел-отрицательная группа крови. Впервые она была зарегистрирована в 1952 году, когда у пациентки по имени миссис Вел (Vel), страдающей карциномой толстого кишечника, повторное переливание донорской крови вызвало тяжелую реакцию отторжения.
Тогда медики выяснили, что первое переливание крови привело к формированию антител к какой-то неизвестной молекуле. Этой молекулы, присутствующей в мембране эритроцитов у подавляющего большинства людей, у миссис Вел не оказалось, что и вызвало при следующем переливании крови столь сильный иммунный ответ. Однако определить, что же это за молекула, удалось только теперь, более 60 лет спустя.
В погоне за неуловимой молекулой
Успеха добились французские медики из Национального института переливания крови в Париже под руководством профессора Лионеля Арно (Lionel Arnaud) в сотрудничестве с американскими коллегами из Вермонтского университета в Берлингтоне во главе с профессором Брайаном Баллифом (Bryan Ballif). Французский ученый поясняет: «Самое сложное в этом исследовании было связано с тем, что антитела, вырабатываемые иммунной системой вел-отрицательного реципиента при переливании ему крови вел-положительного донора, вызывают тяжелую реакцию отторжения лишь в самом организме пациента, а вне его их активность ничтожна.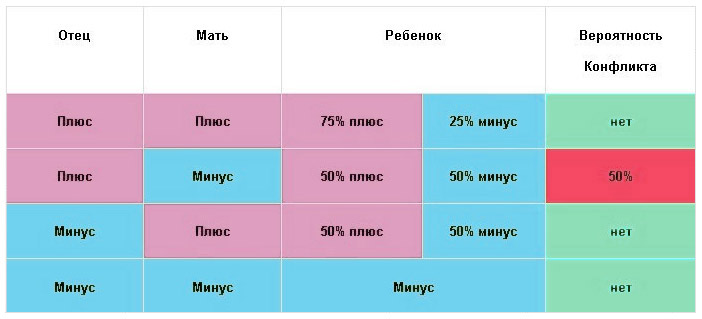
Между тем, потребность в методике, позволяющей выявлять вел-отрицательных реципиентов и вел-отрицательных доноров до того, как дело дошло до тяжелых гемотрансфузионных осложнений, весьма велика. Пусть люди с такой группой крови встречаются очень редко (их доля составляет в среднем лишь один к двум с половиной тысячам), но это все же означает, что только в Европе и Северной Америке проживает почти полмиллиона человек, которым в случае переливания крови грозит смертельная опасность.
Очередное проявление эффекта бабочки
Но выявить эту группу крови можно было лишь с помощью антител, изъятых у пациентов, ранее идентифицированных в качестве вел-отрицательных после отторжения ими донорской крови. Понятно, что большинство больниц и станций переливания крови не располагали ни техническими, ни материальными возможностями для такого скрининга. Иное дело — теперь, когда французским и американским ученым удалось, наконец, выявить и идентифицировать ту загадочную белковую молекулу на поверхности эритроцита, которая и была виновницей всех бед.
Результат оказался несколько неожиданным для самих исследователей, признает профессор Арно: «Этот белок оказался, как мы говорим, самым простым из всех, какие только можно себе представить. И он почти целиком погружен в мембрану эритроцита, так что наружу выглядывает лишь крохотный кончик молекулы. Да и вся молекула столь мала, что этот белок вообще не считался возможным кандидатом. На кодирующий его ген при секвенировании генома человека особого внимания не обратили: отметили только, что должен быть такой белок, и все. Тут мы снова имеем дело с так называемым эффектом бабочки: сущая, казалось бы, мелочь может вызвать весьма и весьма серьезные последствия».
Трансатлантическая научная кооперация
Работа протекала так: сперва французским ученым удалось биохимическими методами, используя антитела нескольких вел-отрицательных пациентов, изолировать загадочную молекулу с мембраны эритроцита. Эти пробы они отправили в Вермонт, где американские исследователи, преодолев целый ряд трудностей, смогли с помощью масс-спектрометра высокого разрешения расшифровать структуру молекулы и таким образом идентифицировать этот мини-белок. А затем французские ученые провели анализ соответствующего участка ДНК у 70 пациентов с вел-отрицательной группой крови, и убедились в том, что у всех у них ген, который должен кодировать этот мини-белок, имеет дефект и недееспособен. Это стало окончательным подтверждением открытия.
А затем французские ученые провели анализ соответствующего участка ДНК у 70 пациентов с вел-отрицательной группой крови, и убедились в том, что у всех у них ген, который должен кодировать этот мини-белок, имеет дефект и недееспособен. Это стало окончательным подтверждением открытия.
Поскольку возможностей для систематического исследования донорской крови на вел-фактор до сих пор практически не было, медикам приходилось надеяться на «авось», говорит Франц Вагнер (Franz Wagner), сотрудник Донорской службы немецкого Красного креста: «До сих пор эту проблему как бы игнорировали, просто выжидали. Но рано или поздно все же попадался пациент, у которого практически любая донорская кровь вызывала образование антител».
Скрининг донорской крови на вел-фактор не за горами
Вот тогда начинался аврал. Запасы консервированной донорской крови порция за порцией проверялись на вел-фактор с помощью антител этого самого несчастного пациента. Каждый тест длился почти две недели, но ведь иного выхода не было, и поиски продолжались до тех пор, пока, наконец-то, не обнаруживалась кровь вел-отрицательного донора. Бывало, что пациент умирал, так и не дождавшись спасительного переливания, потому что подходящая кровь либо долго не попадалась среди имеющихся запасов, либо ее в данное время не оказывалось вовсе.
Бывало, что пациент умирал, так и не дождавшись спасительного переливания, потому что подходящая кровь либо долго не попадалась среди имеющихся запасов, либо ее в данное время не оказывалось вовсе.
Теперь же ситуация существенно упростится: французско-американская группа ученых уже разработала два экспресс-теста, способных за считанные часы выявлять вел-отрицательную кровь на основе анализа ДНК. Франц Вагнер говорит: «Думаю, что там, где уже и сегодня осуществляется молекулярный скрининг донорской крови, потребуется всего несколько месяцев, а может быть, даже недель, чтобы встроить в систему и тест на вел-фактор. Ведь эти системы устроены так, что добавление нового теста не требует слишком уж больших расходов».
А значит, вскоре донорскую кровь вел-отрицательной группы будут выявлять непосредственно при сдаче и сразу же соответствующим образом маркировать. Тогда в случае необходимости она будет наготове, и пациентам не придется с трепетом ждать, успеют ли биохимики найти спасительную для них порцию подходящей крови.
на что влияют характеристики крови — РТ на русском
Одной из самых популярных новостей понедельника стала подхваченная десятками СМИ история о том, что людей с отрицательным резус-фактором «создали инопланетяне». Традиционная наука, конечно, с этим утверждением не согласится. От чего зависит резус-фактор и обладают ли люди с отрицательным резусом какими-то особенностями, RT рассказал врач-трансфузиолог Андрей Звонков.
— Можете объяснить простыми словами для неспециалистов, что такое резус-фактор?
— Резус-фактор — это белок на мембране эритроцита (эритроциты — клетки крови человека. — RT), который присутствует примерно у 75—78% населения планеты. Где-то у 25% людей нет резус-фактора. Связано это с определённым геном, который либо присутствует, либо отсутствует в хромосомах. Если в хромосомах матери и отца этот ген отсутствует, то у ребёнка будет отрицательный резус-фактор (резус-фактор минус). Но если хотя бы в одной хромосоме (в одном наборе — либо материнском, либо отцовском) этот ген присутствует, резус-фактор у ребёнка будет положительным. Это чистая генетика, которая определяет группу крови и резус.
Это чистая генетика, которая определяет группу крови и резус.
— А резус-фактор как-то связан с группой крови?
— Абсолютно никак не связан.
— Важно ли знать людям, какой у них резус-фактор?
— Важно. Кровь — это паспорт человека. Особенно резус-фактор необходимо знать, если вы являетесь донором.
— Чем отличаются люди с отрицательным резус-фактором? Правда ли, что они особенные?
— Про интеллектуальные способности обладателей отрицательного резус-фактора сказать ничего не могу. На вкус их кровь никак не отличается.
Скажу по поводу групп крови. У людей со второй группой крови выше уровень выживаемости во время чумы. Это доказано статистически. В XIV веке Европа пережила эпидемию чумы, в результате которой среди большинства выживших были те, у кого вторая группа крови.
— Есть ли какой-то определённый набор болезней, которые чаще возникают у людей с отрицательным резус-фактором?
— У нас нет никакой достоверной статистики по этому поводу.
— Сейчас в СМИ активно пишут, что у людей с отрицательным резус-фактором голубые или зелёные глаза — это правда?
— Никаких внешних отличительных черт у людей с отрицательным резус-фактором нет. За цвет сетчатки глаз (пигментацию) отвечают совершенно другие гены.
— Зачастую СМИ пишут, что у девушек с отрицательным резус-фактором могут возникнуть осложнения при беременности. Что вы можете сказать по этому поводу?
— Если девушка, которая собирается рожать, имеет отрицательный резус-фактор, а у будущего отца — положительный резус, то у них наверняка появится ребёнок с положительным резус-фактором. Перед родами в кровеносную систему матери попадает кровь плода и происходит процесс её «подмешивания». В то же время в организме матери образуются антитела, которые попадают в организм будущего ребёнка и могут убить его. В этом и заключается опасность для плода.
Но нет никакой необходимости делать аборт в этом случае. Существует специальная антирезусная вакцина, которая вводится роженице в период её беременности. Она препятствует выработке опасных для плода антител. Этот препарат сейчас доступен в аптеках.
Она препятствует выработке опасных для плода антител. Этот препарат сейчас доступен в аптеках.
Люди с отрицательным резусом – не люди, а инопланетяне?
В едином мнении о том, что человеческая популяция произошла от Homo Sapiens и еще одного таинственного вида, который и «подарил» людям резус-отрицательный тип крови, сошлись историки и генетики. Почему возникла такая теория Дело в том, что человечество размножается строго по законам генетики. Родители передают своим детям только те свойства, какими обладали их общие предки. Даже генные мутации неслучайны и ограничены наследственными признаками популяции. Это значит, что если человек произошел от обезьяны, то их кровь должна быть совместимой.
Но у всех без исключения приматов на планете резус-фактор положительный! Этот факт уже давно не давал покоя ученым, и в результате родилась теория, что люди с RH(-) произошли от внеземной расы.
Что такое отрицательный резус-фактор Существует 35 систем групп крови, организованных нашей генетической структурой.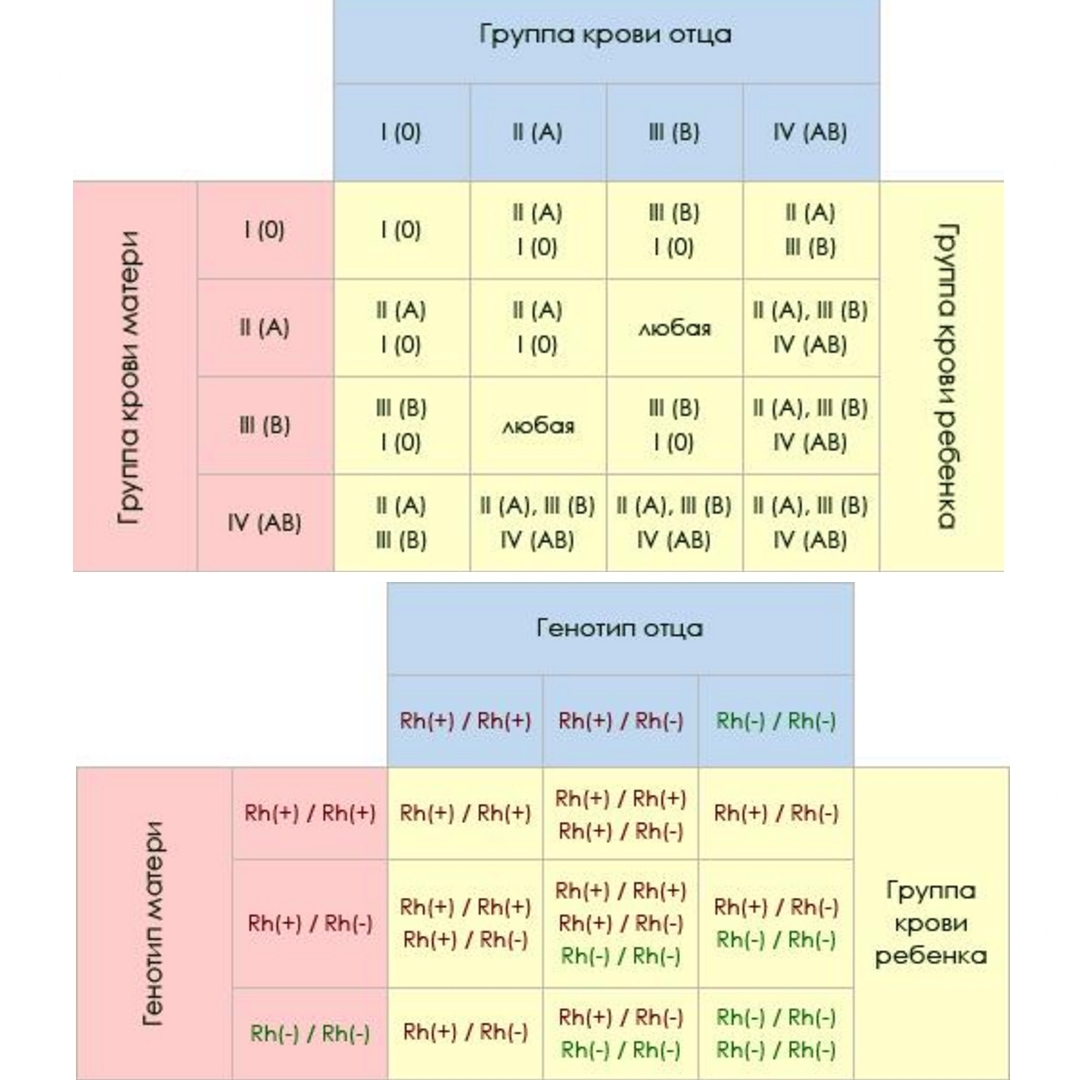 Одна из них — система резуса, включающая 50 антигенов. Антиген в узком смысле — это белок, а в широком понимании — молекула, отвечающая за иммунный ответ организма на атаку враждебных агентов (токсинов, вирусов, бактерий).
Одна из них — система резуса, включающая 50 антигенов. Антиген в узком смысле — это белок, а в широком понимании — молекула, отвечающая за иммунный ответ организма на атаку враждебных агентов (токсинов, вирусов, бактерий).
Например, когда инородное вещество или токсин попадает в наш организм, то антигены «приказывают» иммунитету атаковать их. Таким белком является и антиген D, который находится на поверхности красных кровяных телец. Но не у всех людей он есть! Известно, что примерно 14-15% населения Земли не имеют антигена D на поверхности эритроцитов, то есть их кровь имеет отрицательный резус-фактор: Rh(-).
На что влияет Rh(-) По мнению медиков, отрицательный резус-фактор никак не влияет на здоровье человека. Но антиген D агрессивно реагирует, если вступает в контакт с резус-отрицательной кровью. Эта клиническая характеристика жизненно важна для пациентов, так как при смешивании резус факторов (например, если положительную кровь влить человеку с Rh(-)) возникает мощнейший ответ иммунной системы, и организм начинает уничтожать «пришельцев», что приводит к летальному исходу.
Также если женщина с резус-отрицательной кровью вступит в половой контакт с мужчиной с Rh(+) и забеременеет резус-положительным ребенком, ее организм начнет вырабатывать антигены, сигнализирующие иммунной системе, что плод по существу токсичен. Как ни странно, тело женщины убьет свой собственный плод. Это осложнение известно как гемолитическая болезнь. Спасти ребенка можно только инъекций Rh(-)D иммуноглобулина.
Характеристики людей с отрицательным резус-фактором Исследователи утверждают, что люди с резус-отрицательной кровью имеют свои особенности: повышенная физическая выносливость; значение IQ выше среднего; пониженная температура тела; склонность к гипертонии; волосы с рыжим оттенком; глаза зеленого или светло-серого цвета; острое зрение и особая чувствительность глаз к солнечному свету; повышенная интуиция; сверхъестественные способности (настоящие медиумы или экстрасенсы почти всегда имеют кровь с отрицательным резус-фактором).
Уфологи утверждают, что инопланетяне похищают людей с Rh(-). Еще момент: ученые не могут клонировать людей с отрицательным резус-фактором, так как в процессе генного копирования развивается так называемая естественная стерилизация.
Еще момент: ученые не могут клонировать людей с отрицательным резус-фактором, так как в процессе генного копирования развивается так называемая естественная стерилизация.
Интересные факты Как было сказано выше, только 15 процентов населения на планете имеют резус-отрицательную кровь. Но этот процент населения не распространен равномерно по Земле.
Например, людей с отрицательным типом крови практически нет в Африке, Америке и Азии. Ген, ответственный за отсутствие антигена D в крови, в основном обнаруживается у кавказцев и испанских басков.
Баски — это необычный народ, населяющий небольшой регион на Пиренейском полуострове, между Францией и Испанией. В мире ученых уже давно идут дискуссии о происхождении этого народа. Удивительным является тот факт, что их язык не связан ни с одним другим языком на планете, то есть является полностью изолированным!
Кстати, генная инженерия доказала родство кавказцев и басков — двух народностей, представители которых имеют отрицательный резус-фактор.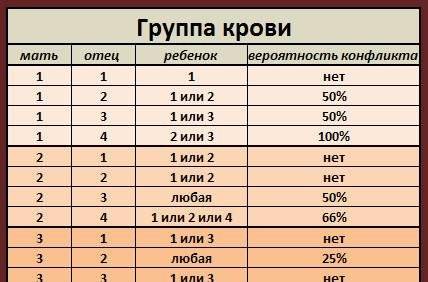 Так кто же был их общим предком? Имеет ли право на существование идея о том, что родоначальниками небольшого процента населения были представители внеземной цивилизации?
Так кто же был их общим предком? Имеет ли право на существование идея о том, что родоначальниками небольшого процента населения были представители внеземной цивилизации?
Кстати, Библия гласит, что ангелы спустились с небес, и «Сыны Божии увидели дочерей человеческих, что они красивы, и взяли их в жены». Если отступить от религиозных представлений о сотворении мира, то можно предположить, что инопланетяне прибыли на Землю и с помощью передовых технологий генной инженерии попытались создать новую расу сверхлюдей.
Еще один интересный факт: почти все представители британской королевской семьи имеют отрицательный резус-фактор.
fb.ru
Советы людям с отрицательным резус-фактором | Здоровая жизнь | Здоровье
Слово – нашему эксперту, врачу-трансфузиологу Андрею Звонкову. По нашей просьбе он ответил на самые интересные вопросы наших читателей, связанные с этой темой.
Минус или плюс?
Скажите, как часто встречаются люди с отрицательным резус-фактором и что это значит?
Валентин, Подольск
– Резус-фактор представляет собой особый вид протеина, который находится на поверхности красных кровяных телец (эритроцитов).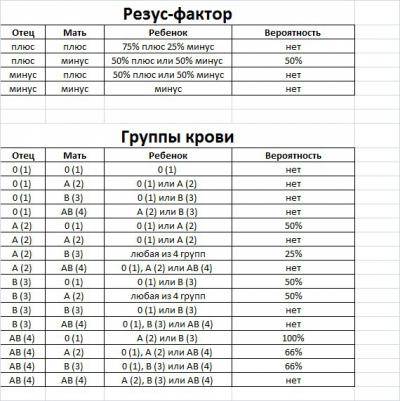 Этот белок есть у 80% жителей планеты. Таких людей называют резус-положительными. Если же белка на оболочке эритроцитов нет – резус-отрицательными. Таковых соответственно – 20%.
Этот белок есть у 80% жителей планеты. Таких людей называют резус-положительными. Если же белка на оболочке эритроцитов нет – резус-отрицательными. Таковых соответственно – 20%.
При этом никаких особых неудобств своему обладателю наличие «отрицательной» крови не доставляет. Это не болезнь и не патология, а всего лишь один из вариантов генетического наследования.
Двойной риск
Год назад я сделала аборт, тогда не могла себе позволить родить ребенка. Теперь ситуация изменилась, и я мечтаю о малыше. Но у меня орицательный резус-фактор. Скажите, тот аборт может повлиять на беременность?
Ольга, Можайск
– К сожалению, да. В процессе аборта в кровоток матери может попасть кровь плода. Выработавшиеся в ответ на это антитела при последующей беременности способны проникнуть через плацентарный барьер в кровоток еще не родившегося ребенка, разрушая его эритроциты, угрожая его жизни. Особенно опасно в этом плане прерывание первой беременности, которое может привести к бесплодию.
В последнее время для профилактики резус-конфликта женщине вводят после родов или абортов антирезус-иммуноглобулин. Если такой профилактики вам сделано не было, этот препарат нужно ввести сразу после наступления последовавшей после аборта беременности. И регулярно в течение всей беременности нужно сдавать анализ крови на наличие антирезусных антител.
Фильтр проблем
Слышала, что проблему резус-сенсибилизации можно решить с помощью плазмафереза. Но разве беременным это можно делать?
Маргарита, Ярославль
– Не только можно, но и нужно! Удаляя губительные для плода антитела из русла крови или снижая их концентрацию, плазмаферез (методика очистки крови) является весьма эффективной профилактикой резус-конфликта. Правда, в том случае, если у женщины присутствуют в крови так называемые полные антитела, которые медленно синтезируются и сложнее проходят плацентарный барьер. «Вытащить» беременность с неполными антителами гораздо сложнее: они синтезируются за 10–14 часов, а «чистить кровь» каждый день нельзя. Минимум – через 1–1,5 дня. Для того чтобы удержать нормальный титр антител, некоторым женщинам приходится проходить эту процедуру на протяжении всей беременности.
Минимум – через 1–1,5 дня. Для того чтобы удержать нормальный титр антител, некоторым женщинам приходится проходить эту процедуру на протяжении всей беременности.
Настоящей палочкой-выручалочкой стал плазмаферез и при лечении токсикозов первой и второй половины беременности, а также при плацентарной недостаточности, которая служит основной причиной внутриутробной гипоксии (кислородное голодание) и задержки роста плода.
Анализируй это!
Источник фото: TS/Fotobank.ruВ каких ситуациях необходимо определение резус-фактора крови? И нужно ли для экстренных случаев носить с собой памятку о том, какая у тебя кровь?
Евгения, Воронежская обл.
– Такой анализ необходимо сделать перед плановым хирургическим вмешательством, переливанием крови и в период планирования беременности.
А вот постоянно носить с собой памятку о том, какая у вас кровь, не имеет смысла. Согласно приказу Минздравсоцразвития, который действует во всех лечебных учреждениях нашей страны, перед каждым переливанием крови каждому поступающему в больницу человеку в обязательном порядке перепроверяется его группа крови и резус-фактор, поскольку нет гарантии, что они были определены правильно.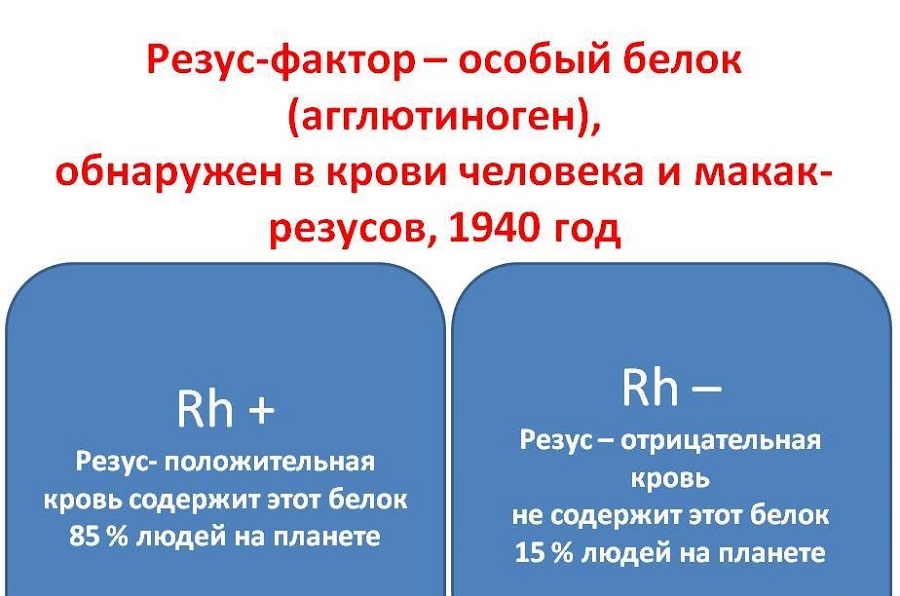
Конфликта не будет?
У меня – отрицательный резус крови, а у мужа – положительный. Недавно я узнала, что беременна. Говорят, с таким сочетанием меня ожидают большие проблемы. Это правда?
Екатерина, Калининград
– При первой беременности особых проблем у резус-отрицательных женщин (даже в том случае, если она ожидает рождения резус-положительного ребенка), как правило, не возникает, поскольку иммунная система матери впервые встречается с чужеродными ей эритроцитами и, следовательно, губительных для плода антител в ее крови вырабатывается еще мало.
Все гораздо серьезнее, когда такая женщина беременеет второй раз. Ведь в ее крови теперь присутствуют защитные антитела («клетки памяти»), оставшиеся от прежней беременности. Поэтому вероятность резус-конфликта (своего рода аллергической реакции, когда тело матери начинает воспринимать плод как чужеродный элемент) возрастает. Подобное развитие событий чревато очень серьезными последствиями, вплоть до внутриутробной гибели плода.
К счастью, современные медицинские технологии позволяют решить эту проблему. Предупредить ее помогает введение специальной вакцины – антирезус-иммуноглобулина, который подавляет развитие и синтез антирезусных антител и помогает женщине выносить беременность и родить здорового малыша.
Невероятное? Очевидное!
Источник фото: TS/Fotobank.ruУ моего ребенка – отрицательный резус-фактор крови, в то время как у нас с мужем кровь положительная. Муж до сих пор подкалывает меня по этому поводу: мол, от кого нагуляла? Я-то знаю, что ничего не было. Но не дает покоя вопрос: как такое могло получиться? Ведь ребенок обязательно наследует кровь своих родителей. Разве не так?
Ольга, Кострома
– Нет, не так. Ничего сверхъестественного в вашей ситуации нет. Объясняется она тем, что человек с положительным резус-фактором может быть носителем гена отрицательного резуса, который подавляется более сильным положительным геном.
Но когда в крови обоих родителей присутствует этот отрицательный ген, то, удвоив свою силу, он может передаться ребенку и сформировать у него резус со знаком «минус».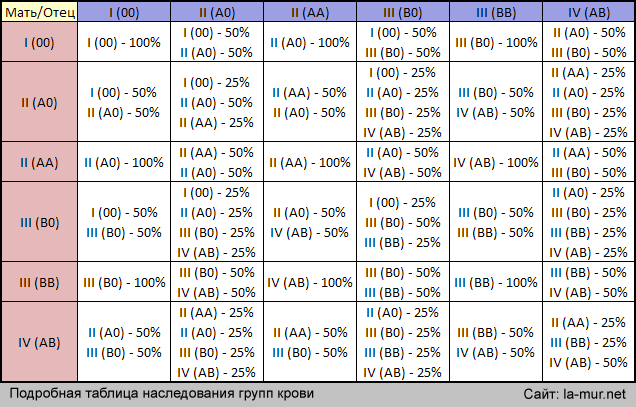 По статистике, у резус-положительных родителей такая ситуация возможна в 25% случаев.
По статистике, у резус-положительных родителей такая ситуация возможна в 25% случаев.
Запас не нужен?
Скоро мне предстоит серьезная операция на сердце. Но у меня – резус-отрицательная кровь. Говорят, в таких случаях нужно идти на станцию переливания крови и сдавать ее «про запас» – на случай кровотечения. Стоит ли это делать?
Всеволод, Москва
– Резус-отрицательная кровь всегда в дефиците. Но, если речь идет о плановой операции, как у вас, кровь под нее лечебное учреждение, как правило, заказывает заранее. Особенно если ожидается риск развития кровотечения.
Сложная ситуация с резус-отрицательной донорской кровью может возникнуть в случае экстренной операции, когда человек поступает в больницу после ДТП или другого несчастного случая. Здесь уже раздумывать нельзя. Нужно действовать. Как? Обратиться на станции переливания крови, расположенные в крупных (лучше федеральных) медицинских центрах. Или искать нужную кровь в городской лечебной сети. Если же решить этот вопрос таким образом не удалось, нужно бросить клич по друзьям и знакомым или идти в ближайшую войсковую, пожарную часть и искать добровольных доноров с нужным вам резусом крови.
Если же решить этот вопрос таким образом не удалось, нужно бросить клич по друзьям и знакомым или идти в ближайшую войсковую, пожарную часть и искать добровольных доноров с нужным вам резусом крови.
Кстати, собираясь на операцию, вспомните, не было ли у вас когда-нибудь массивной гемотрансфузии (переливание крови). В этом случае подбирать вам донорскую кровь нужно особенно тщательно. Иначе при очередном переливании крови у вас могут возникнуть серьезные, а то и угрожающие жизни проблемы, вне зависимости от вашего резус-фактора.
Смотрите также:
Отрицательный резус-фактор крови: Rh(-) — Всё совершенно иначе! — LiveJournal
Исследования зарубежных ученых подтверждают, что у людей с Rh(–) действительно много отличий от Homo sapiens с положительным резус-фактором. Некоторые исследователи даже считают данный факт доказательством внеземного происхождения «минусовых».
Что такое отрицательный резус-фактор
Существует 35 систем групп крови, организованных нашей генетической структурой.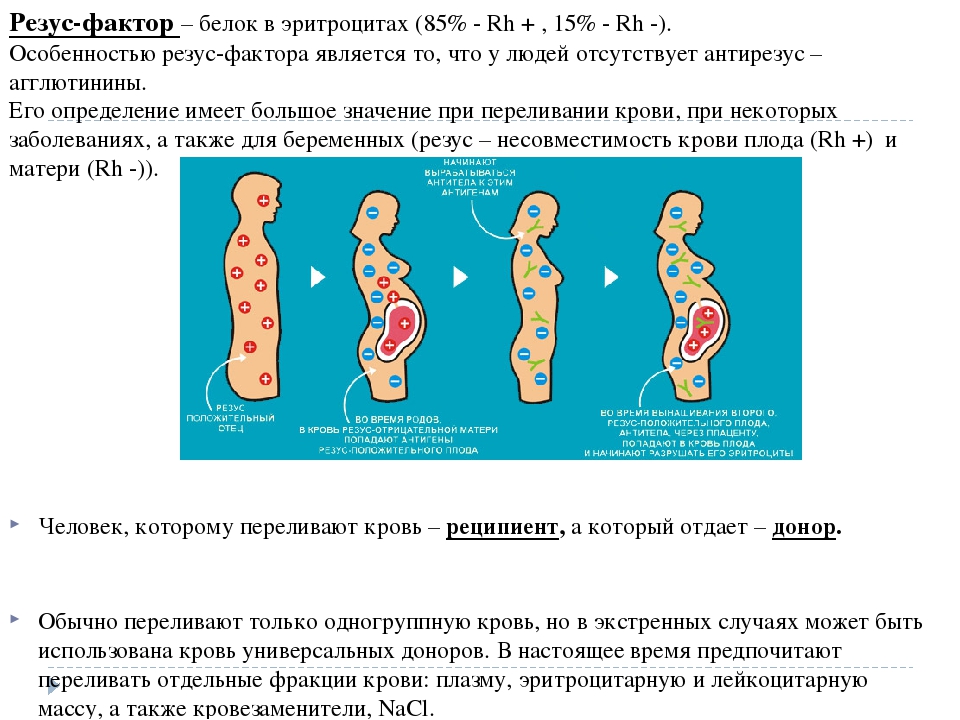 Одна из них — система резуса, включающая 50 антигенов. Антиген в узком смысле — это белок, а в широком понимании — молекула, отвечающая за иммунный ответ организма на атаку враждебных агентов (токсинов, вирусов, бактерий). Например, когда инородное вещество или токсин попадает в наш организм, то антигены «приказывают» иммунитету атаковать их.
Одна из них — система резуса, включающая 50 антигенов. Антиген в узком смысле — это белок, а в широком понимании — молекула, отвечающая за иммунный ответ организма на атаку враждебных агентов (токсинов, вирусов, бактерий). Например, когда инородное вещество или токсин попадает в наш организм, то антигены «приказывают» иммунитету атаковать их.
Таким белком является и антиген D, который находится на поверхности красных кровяных телец. Но не у всех людей он есть! Известно, что примерно 14-15% населения Земли не имеют антигена D на поверхности эритроцитов, то есть их кровь имеет отрицательный резус-фактор: Rh(-).
Люди с Rh(–) – инопланетяне?
Самый известный популяризатор такой версии – американский исследователь Брэд Стайгер. Правда, Стайгер специализируется больше на доисторической археологии, которую пытается связать с паранормальными явлениями.
Используя результаты последних исследований гематологов, Брэд Стайгер пришел к выводу, что люди с отрицательным резус-фактором либо произошли от другой ветви «человека разумного» (со своей линией ДНК), нежели все остальные, либо их предки и вовсе представители внеземного разума. Стайгер задался вопросом: раз уж человек произошел от обезьяны, то почему тогда у всех приматов Rh(+), а у людей возможен еще и Rh(–)?
Стайгер задался вопросом: раз уж человек произошел от обезьяны, то почему тогда у всех приматов Rh(+), а у людей возможен еще и Rh(–)?
Что особенного в «резус-отрицательных»?
По наблюдениям гематологов, около трети всех обладателей Rh(–) имеют определенные национальности – такой резус фактор чаще встречается у евреев, испанских басков, эфиопов и эфиопских евреев, самаритян. У представителей других народов он ничтожен, порядка процента.
В крови Rh(–) отсутствует белок, защищающий организм от бактерий, провоцирующих возникновение ряда болезней, поэтому «отрицательные» обладают меньшим иммунитетом. Такие люди более теплолюбивы и сдержанны, чем обладатели Rh(+). Интеллектуальный уровень у них несколько выше, подмечено, что разные маги, шаманы и знахари – это люди как раз с отрицательным резус-фактором. «Отрицательные» не годятся для клонирования. Беременная женщина с Rh(–) рискует не доносить ребенка – организм его отторгает, вследствие чего таким матерям в период беременности пригодится проходить спецлечение.
На что влияет Rh(-)
По мнению медиков, отрицательный резус-фактор никак не влияет на здоровье человека. Но антиген D агрессивно реагирует, если вступает в контакт с резус-отрицательной кровью. Эта клиническая характеристика жизненно важна для пациентов, так как при смешивании резус факторов (например, если положительную кровь влить человеку с Rh(-)) возникает мощнейший ответ иммунной системы, и организм начинает уничтожать «пришельцев», что приводит к летальному исходу.
Также если женщина с резус-отрицательной кровью вступит в половой контакт с мужчиной с Rh(+) и забеременеет резус-положительным ребенком, ее организм начнет вырабатывать антигены, сигнализирующие иммунной системе, что плод по существу токсичен. Как ни странно, тело женщины убьет свой собственный плод. Это осложнение известно как гемолитическая болезнь. Спасти ребенка можно только инъекций Rh(-)D иммуноглобулина.
Как и чем болеют пациенты с Rh(–)
Три года назад чешскими учеными были опубликованы данные о частоте и градации болезней людей с Rh(–) сравнительно с пациентами с Rh(+).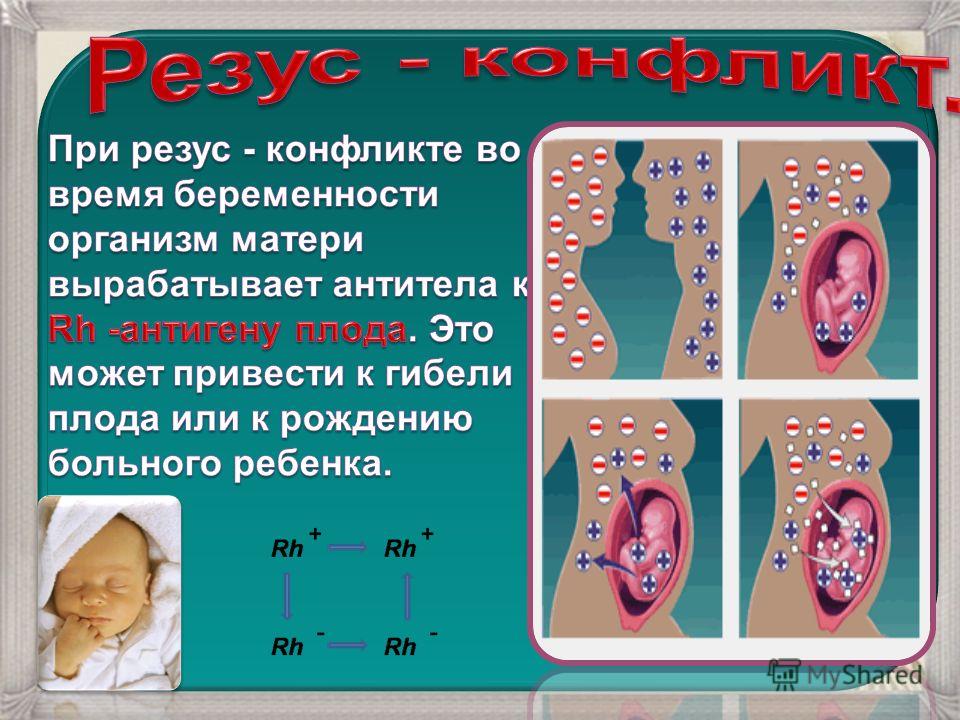 Результаты показали, что в данном случае заболевания разнятся и по гендерному характеру. К примеру, стало известно о такой примечательной особенности: мужчины с Rh(–) более подвержены психическим расстройствам, аллергиям, анемиям. У них чаще возникают проблемы с печенью, «отрицательные» мужчины более склонны к инфекционным заболеваниям и остеопорозу.
Результаты показали, что в данном случае заболевания разнятся и по гендерному характеру. К примеру, стало известно о такой примечательной особенности: мужчины с Rh(–) более подвержены психическим расстройствам, аллергиям, анемиям. У них чаще возникают проблемы с печенью, «отрицательные» мужчины более склонны к инфекционным заболеваниям и остеопорозу.
Вместе с тем, у мужчин с Rh(–), не имеющих в крови белка RhD, меньше проблем с пищеварением, желчным пузырем, аденомой простаты, бородавками, некоторые виды рака у них также встречаются реже.
Женщины с Rh(–) чаще болеют псориазом, диабетом 2 типа, инфекционными заболеваниями мочевых путей, сколиозом, страдают от недостатка в организме витамина В. Вместе с тем, они менее подвержены расстройствам психики, дерматозам, болезням, что лечат отоларингологи.
«Отрицательные» люди, по наблюдениям гематологов, немного чаще подвержены заболеваниям сердечно-сосудистой, дыхательной и иммунной систем, но вместе с тем их организм более эффективно «отбивает» вирусные инфекции. Все дело в наличии (и отсутствии) в крови того самого белка RhD, которые есть у людей Rh(+) и отсутствует у Homo sapiens с Rh(–).
Все дело в наличии (и отсутствии) в крови того самого белка RhD, которые есть у людей Rh(+) и отсутствует у Homo sapiens с Rh(–).
Как считают ученые, отличие в восприимчивости организмов с разными резус-факторами крови к различным заболеваниям, хотя и не существенное, но все же имеется. Однако до конца природу и функцию белка RhD гематологи еще не разгадали.
Характеристики людей с отрицательным резус-фактором
Исследователи утверждают, что люди с резус-отрицательной кровью имеют свои особенности:
- повышенная физическая выносливость;
- значение IQ выше среднего;
- пониженная температура тела;
- склонность к гипертонии;
- волосы с рыжим оттенком;
- глаза зеленого или светло-серого цвета;
- острое зрение и особая чувствительность глаз к солнечному свету;
- повышенная интуиция;
- сверхъестественные способности (настоящие медиумы или экстрасенсы почти всегда имеют кровь с отрицательным резус-фактором).

Уфологи утверждают, что инопланетяне похищают людей с Rh(-). Еще момент: ученые не могут клонировать людей с отрицательным резус-фактором, так как в процессе генного копирования развивается так называемая естественная стерилизация.
Интересные факты
Как было сказано выше, только 15 процентов населения на планете имеют резус-отрицательную кровь. Но этот процент населения не распространен равномерно по Земле. Например, людей с отрицательным типом крови практически нет в Африке, Америке и Азии. Ген, ответственный за отсутствие антигена D в крови, в основном обнаруживается у кавказцев и испанских басков.
Баски — это необычный народ, населяющий небольшой регион на Пиренейском полуострове, между Францией и Испанией. В мире ученых уже давно идут дискуссии о происхождении этого народа. Удивительным является тот факт, что их язык не связан ни с одним другим языком на планете, то есть является полностью изолированным! Кстати, генная инженерия доказала родство кавказцев и басков — двух народностей, представители которых имеют отрицательный резус-фактор. Так кто же был их общим предком? Имеет ли право на существование идея о том, что родоначальниками небольшого процента населения были представители внеземной цивилизации?
Так кто же был их общим предком? Имеет ли право на существование идея о том, что родоначальниками небольшого процента населения были представители внеземной цивилизации?
Кстати, Библия гласит, что ангелы спустились с небес, и «Сыны Божии увидели дочерей человеческих, что они красивы, и взяли их в жены». Если отступить от религиозных представлений о сотворении мира, то можно предположить, что инопланетяне прибыли на Землю и с помощью передовых технологий генной инженерии попытались создать новую расу сверхлюдей.
Еще один интересный факт: почти все представители британской королевской семьи имеют отрицательный резус-фактор.
Николай Сыромятников
Инопланетяне среди нас: почему людей с отрицательным резус-фактором крови считают потомками пришельцев — ReadWeb
О том, что на Землю периодически прилетают инопланетяне и вступают в контакты с населением нашей планеты, давным-давно ходит масса слухов и легенд. Кто-то в это верит, кто-то – нет. Однако слышали ли вы о том, что среди жителей земного шара могут быть инопланетные потомки? И это – те, у кого отрицательный резус-фактор…
Однако слышали ли вы о том, что среди жителей земного шара могут быть инопланетные потомки? И это – те, у кого отрицательный резус-фактор…
О резус-факторах
Резус-фактор – это определенный антиген, который содержится в крови макаки-резус и человека. У большинства людей он положительный, то есть такой же, как и у макаки. Иными словами, это дает возможность предположить, что раз данный антиген у человека и у макаки совпадает, значит, у них имелся общий предок.
Однако некоторое количество человек (их не так много, всего десять-пятнадцать процентов от общего населения земного шара) положительного резус-фактора не имеют – он у них со знаком «минус». Таким людям не хватает не только этого гена макаки-резус, но и тех белков, которые идут с ним «в комплекте». Соответственно, про них нельзя сказать, что у них одинаковый предок с макакой-резус. Возникает вопрос: откуда взялись эти люди?
Отрицательный резус-фактор
Интересно, что отрицательный резус-фактор часто характеризуется определенными особенностями как во внешности, так и в характере, и в возможностях человека. Например, те, чья кровь резус-отрицательная, чаще всего рыжеволосые с голубыми, зелеными или карими глазами. У них более высокий уровень интеллекта, они обладают развитой способностью к эмпатии, пониженным иммунитетом, теплолюбивы, чувствительны и нередко имеют кучу непонятных фобий. Также, по предположениям ученых, подобных людей невозможно клонировать. Так что, если у вас резус-отрицательная кровь и есть вышеперечисленные признаки, вы можете гордиться: таких, как вы, на Земле очень мало.
Например, те, чья кровь резус-отрицательная, чаще всего рыжеволосые с голубыми, зелеными или карими глазами. У них более высокий уровень интеллекта, они обладают развитой способностью к эмпатии, пониженным иммунитетом, теплолюбивы, чувствительны и нередко имеют кучу непонятных фобий. Также, по предположениям ученых, подобных людей невозможно клонировать. Так что, если у вас резус-отрицательная кровь и есть вышеперечисленные признаки, вы можете гордиться: таких, как вы, на Земле очень мало.
Считается, что люди с отрицательным резус-фактором появились приблизительно 35 тысяч лет назад, и наиболее концентрировались на территории Северной Испании и Южной Франции. Что касается племен, то максимально часто «отрицательные» люди встречались среди испанских басков, а также нередки были среди восточных евреев.
Интересный факт
Дело в том, что резус-отрицательная кровь несовместима с резус-положительной. Особенно это проявляется при вынашивании ребенка. Если мужчина имеет резус-положительную кровь, а женщина – резус-отрицательную, с большой вероятностью их плод тоже будет резус-положительным. В таком случае женщине будет крайне тяжело выносить его, поскольку ее резус-отрицательный организм будет отторгать резус-положительного ребенка. Ее кровь будет вырабатывать антитела, атакующие эритроциты в крови будущего малыша. Подобную несовместимость и, как следствие, гибель плода (выкидыш или мертворождение) можно предотвратить с помощью введения специального иммуноглобулина.
В таком случае женщине будет крайне тяжело выносить его, поскольку ее резус-отрицательный организм будет отторгать резус-положительного ребенка. Ее кровь будет вырабатывать антитела, атакующие эритроциты в крови будущего малыша. Подобную несовместимость и, как следствие, гибель плода (выкидыш или мертворождение) можно предотвратить с помощью введения специального иммуноглобулина.
Потомки инопланетян?
Если обратиться к древней истории, то можно вспомнить огромное количество рисунков и надписей, которые рассказывают о посещении Земли инопланетными гостями. Так что неудивительно, что очень большое количество людей верит: инопланетяне действительно прилетали, а люди с отрицательным резус-фактором возникли в результате союза этих инопланетян и древних землян.
Если принять эту теорию за правду, тогда у инопланетных пришельцев должно быть очень схожее с человеческим строение тела, а различия могли быть совершенно незначительными и выражаться в цвете глаз, волос или типе крови. Вышеприведенный факт о невозможности вынашивания резус-положительного ребенка резус-отрицательной матерью, по мнению многих ученых-приверженцев этой теории, тоже говорит в ее пользу: отрицательная кровь убивает положительную, потому что они «неродные».
Вышеприведенный факт о невозможности вынашивания резус-положительного ребенка резус-отрицательной матерью, по мнению многих ученых-приверженцев этой теории, тоже говорит в ее пользу: отрицательная кровь убивает положительную, потому что они «неродные».
Генетическая мутация
Разумеется, у вышеприведенной теории есть и противники. Скептики считают, что все это ерунда, а появление на Земле людей с резус-отрицательной кровью обусловлено различными генетическими мутациями, например, вследствие сильного воздействия ультрафиолета. Сторонники первой теории подвергают это оспариванию, утверждая, что в таком случае людей-носителей отрицательного резус-фактора было бы значительно больше.
Дети богов
Есть и третья теория, по которой отрицательный резус-фактор возник не из-за мутаций и не из-за инопланетян, но благодаря связи древних землян с… божественными существами.
Якобы от связи падших ангелов с земными женщинами родились дети-исполины, от которых и пошла отдельная ветвь потомков с отрицательным резус-фактором.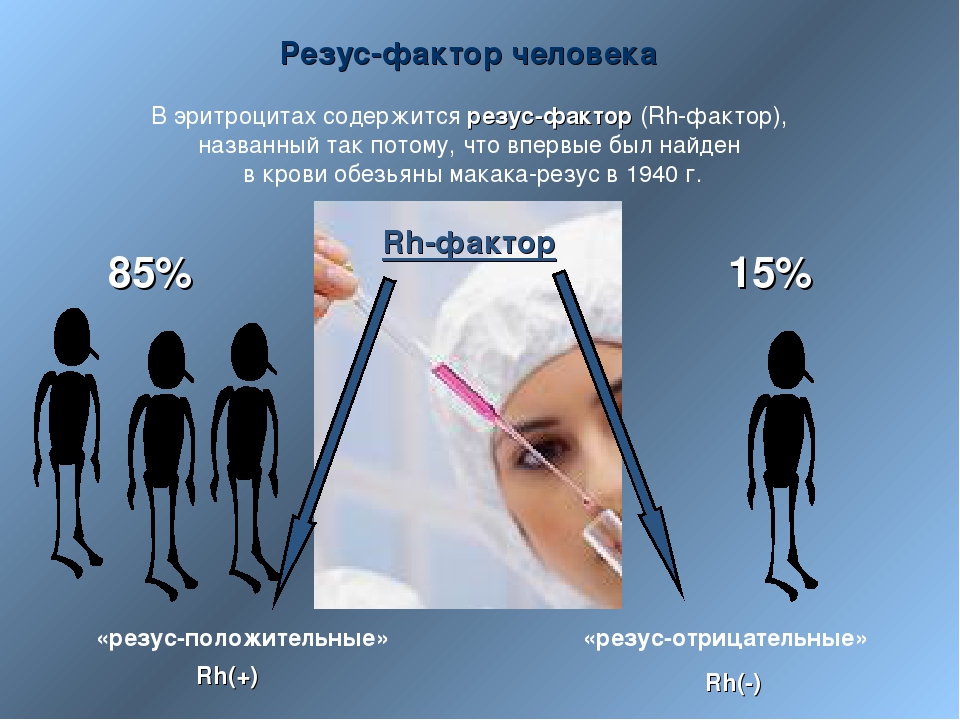 Про это упоминается даже в Библии, однако о резус-факторах, разумеется, там нет ни слова.
Про это упоминается даже в Библии, однако о резус-факторах, разумеется, там нет ни слова.
Источник
Генетика системы групп крови резус
Переливание крови. 2007 Apr; 5 (2): 50–57.
Institut für Klinische Transfusionsmedizin und Immungenetik Ulm und Institut für Transfusionsmedizin, Universitätsklinikum Ulm, Германия
Для переписки: Prof. Dr. med. Вилли А. Флегель, Institut für Transfusionsmedizin, Universitätsklinikum Ulm, Helmholtzstrasse 10 — 89081 Ulm — Германия, электронная почта: [email protected]Ключевые слова: Резус, группа крови, молекулярная диагностика, переливание крови, беременность
Эта статья цитировалась в других статьях в PMC. Фактор резус клинически является наиболее важной системой группы крови, основанной на белках. На данный момент описано 49 антигенов, это самая большая из 29 систем групп крови. Необычно большое количество антигенов резуса объясняется его сложной генетической основой. Антигены расположены на двух резус-белках — RhD и RhCE — и продуцируются различиями в их белковых последовательностях. В номенклатуре CD они обозначены как CD240D и CD240CE. В отличие от белков других групп крови, резус-белки экспрессируются только в мембранах красных кровяных телец и их ближайших предшественниках 1 .
Антигены расположены на двух резус-белках — RhD и RhCE — и продуцируются различиями в их белковых последовательностях. В номенклатуре CD они обозначены как CD240D и CD240CE. В отличие от белков других групп крови, резус-белки экспрессируются только в мембранах красных кровяных телец и их ближайших предшественниках 1 .
Резус уступает по клинической значимости только группе крови АВО. С момента внедрения послеродовой анти-D-профилактики в конце 1960-х и комбинированной пред- и послеродовой анти-D-профилактики в начале 1990-х годов частота гемолитической болезни у новорожденных из-за аллоиммунизации снизилась более чем на 90%. До 1% всех беременных имеют клинически значимые антиэритроцитарные антитела 2 , 3 .
Anti-D остается основным показанием для фототерапии или обменных переливаний у новорожденных. 2 , 4 , а у беременных женщин с отрицательным результатом D уровень заболеваемости выше среднего.
Пять наиболее важных антигенов резуса являются причиной большинства аллоиммунизаций после переливания крови. В соответствии с немецкими рекомендациями по гемотерапии [ Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten ] 5 , D-отрицательные реципиенты переливания крови всегда должны получать D-отрицательные эритроциты.
С 2000 года женщины репродуктивного возраста и девочки также получали переливания крови, совместимые с другими антигенами резуса, такими как C, c, E и e, в дополнение к антигену K группы крови Kell 5 .
Эта процедура также применима к пациентам, которые получают регулярные переливания крови или имеют иммуногематологические проблемы, такие как алло- и аутоантитела к эритроцитам. В случае аутоантител их точная специфичность обычно не определяется. Хотя одна треть таких аутоантител направлена на резус-белки, это практически не имеет практических последствий для лечения 1 .
Антиген D, открытый в 1939 году, был первым описанным резус-антигеном. D-положительные пациенты были названы резус-положительными.В 1946 году был открыт количественный вариант со слабо экспрессируемым антигеном D, названный «D u ». Этот вариант, получивший название «слабый D», имеет клиническое и диагностическое значение.
С 1953 года стало ясно, что существуют также качественные варианты D-антигена. Хотя пациенты с этим частичным вариантом D положительны по антигену D, они также могут образовывать анти-D.
Генетическая основа
Чтобы понять генетическую основу болезней, важно понимать индивидуальные различия в генетической изменчивости, а также их частоту и распределение в популяции 6 .Обычно существует тесная корреляция между генотипом и выраженным фенотипом. Таким образом, на примере изменения гена RHD можно сделать выводы об экспрессии белка RhD в мембране эритроцита. Как и в случае со многими вариантами D, модифицированный белок RhD может иметь важное значение для антигенности, связанной с переливанием крови.
Молекулярная основа аллелей
RHПервый ген резуса, ген RHCE , был открыт в 1990 году.Ген RHD был обнаружен два года спустя, и полная делеция этого гена была установлена как причина европейского отрицательного фенотипа D.
С тех пор в гене RHD было обнаружено более 170 аллелей. Сайт до сих пор не изучен полностью, даже через 15 лет после клонирования первого гена RH . DNB, самый распространенный из всех европейских частичных аллелей D , был описан в 2002 г. 7 .
В 2002 году сравнения между проектом «Геном человека» и проектом «Геном млекопитающих» улучшили понимание образования двух генов RH на хромосоме 1 () 8 .
Дупликация гена RH и делеция гена RHD Родовое состояние показано как локус гена RH у мыши. Один ген RH соседствует с тремя генами: SMP1 , P29-ассоциированным белком ( P ) и NPD014 ( N ). Дупликация создала второй, обращенный ген RH у человека, который расположен между N и SMP1 . В точках вставки до и после гена RHD находится сегмент ДНК длиной около 9000 нуклеотидов или пар оснований (п.н.).Два сегмента ДНК фланкируют ген RHD и называются восходящим или нижележащим Rhesus box . В положительном гаплотипе RHD ген RHD мог быть снова потерян в результате рекомбинации (). Шкала дает приблизительную длину в 50 000 нуклеотидов в геномной ДНК.
Дупликация создала второй, обращенный ген RH у человека, который расположен между N и SMP1 . В точках вставки до и после гена RHD находится сегмент ДНК длиной около 9000 нуклеотидов или пар оснований (п.н.).Два сегмента ДНК фланкируют ген RHD и называются восходящим или нижележащим Rhesus box . В положительном гаплотипе RHD ген RHD мог быть снова потерян в результате рекомбинации (). Шкала дает приблизительную длину в 50 000 нуклеотидов в геномной ДНК.
У большинства млекопитающих есть только один ген RH , положение которого соответствует гену RHCE человека. Ген RHD возник в результате дупликации наследственного гена RH во время эволюции млекопитающих.Делеция RHD произошла 9 во время эволюции гоминидов, так что многие современные люди полностью лишены гена RHD . Этот гаплотип (глоссарий) является ведущей причиной D-негативного фенотипа во всем мире.
Аллели RH можно сгруппировать в соответствии с их молекулярной структурой. По большей части эти группы показывают точечные мутации (SNP, однонуклеотидные полиморфизмы), которые вызывают бессмысленные, бессмысленные, сдвиги рамки считывания или мутации сайтов сплайсинга (глоссарий).Гибридные аллели RHD-CE-D часто образуются в результате преобразования генов.
Примеры молекулярных изменений и их влияния на D-антиген () показывают, как фенотип D-антигена коррелирует с молекулярной структурой.
Таблица I
Молекулярные изменения в аллелях RHD и их корреляция с фенотипами антигена D
| Молекулярная основа | Типичный пример | Классификация | изменение антигенаФенотип антигена D | Изменение белка | Механизм * | Описание RHD 902 Общее название аллеля 9015 антиген | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Частичный D | Качественно измененный | Аминокислотная замена на внешней поверхности гибридного белка: обмен белкового сегмента на внешней поверхности | Миссенс-мутация | RHD (G35520S) | 90 207 Неизвестно|||||||
| Преобразование генов | RHD-CE (3-6) -D | Тип DVI 3 | BARC | ||||||||
| Слабый D | Слабый D | Слабый D | Слабый D | аминокислоты в мембране или внеклеточно | Миссенс-мутация | RHD (V270G) | Слабый тип D 1 | Неизвестно | |||
| DEL | Количественно заметно ослаблено | на сайте | сильно снижена экспрессия или трансляция белка | Миссенс-мутация RHD (K409K) сплайсинга | RHD (M2951) в C De н / д ** | н / д ** | Неизвестно | ||||
| D отрицательный | D отрицательный | Отсутствует экспрессия белка | Делеция гена Бессмысленная мутация Мутация сдвига рамки Модифицирующий ген | Делеция RHD RHD (Y330X) RHD (488 дел 4) Дефект в гене RHAG | D отрицательный н / д ** н / д ** Rh ноль | невозможно | |||||
| Гибридный белок: обмен белкового сегмента на внешней поверхности | Конверсия гена | -CE (4-7) -D | Cde S | ||||||||
| Антитезный белковый антиген RHCE | Наличие антигена E или e | Миссенс-мутация в аминокислотном положении 226 кодов для антигена E | Миссенс мутация в положении 226 аминокислоты в RHCE | RHCE аллель: Ala 226 кодирует антиген e, Pro 226 кодирует антиген E | n / a ** | E по сравнению с e | |||||
Молекулярная основа фенотипов резуса
Два резус-белка, RhD и RhCE, очень похожи и отличаются только 36 из 417 аминокислот, каждый из которых состоит. Каждый имеет двенадцать сегментов внутри мембраны эритроцита и шесть внеклеточных петель (). Как амино (NH 3 ), так и карбоксильный (COOH) конец расположены внутри клетки.
Каждый имеет двенадцать сегментов внутри мембраны эритроцита и шесть внеклеточных петель (). Как амино (NH 3 ), так и карбоксильный (COOH) конец расположены внутри клетки.
Оба белка резуса содержат 417 аминокислот, показанных здесь кружками. Зрелым белкам в мембране не хватает первой аминокислоты. Аминокислотные замены, которые отличают RhD от белка RhCE, показаны желтым цветом, при этом четыре аминокислоты, которые кодируют антиген C, показаны зеленым цветом, а та, которая кодирует антиген E, — черным.Замены одиночных аминокислот, которые кодируют частичную D, показаны синим цветом, те, которые кодируют слабую D, — красным. Мутации, идентифицированные группой Ulm, отмечены голубым и оранжевым цветом.
D-отрицательный фенотип
Клинически существенное различие между резус-положительным и резус-отрицательным зависит от наличия или отсутствия белка RhD в мембране эритроцитов (D-положительный или D-отрицательный).
Полное отсутствие белков эритроцитов или других клеток у многих людей является необычным.Эта конкретная генетическая особенность способствует сильной антигенности белка RhD. Во время дупликации наследственного гена RH были сформированы два сегмента ДНК, известные как резус-бокс () 9 . Делеция RHD возникла в результате неравного кроссовера (), который происходит, когда два сегмента ДНК являются высокогомологичными, например, таковые из Rhesus box . Отрицательный гаплотип RHD , наиболее распространенный среди европейцев, характеризуется гибридным Rhesus box .Тонкие молекулярные различия между различными формами Rhesus box используются для генетического тестирования.
Делеция гена RHD Делеция гена RHD возникла в результате рекомбинации между вышестоящим и нижележащим Rhesus box на двух разных хромосомах. Это называется неравным кроссовером. Когда две скрещенные нити разделяются (от A по сайту рекомбинации до B), ДНК на участке гена RH полностью лишается гена RHD (C).Этот гаплотип (C) встречается примерно у 41% населения. Человек, гомозиготный по этому гаплотипу (около 17%), является D-отрицательным.
Когда две скрещенные нити разделяются (от A по сайту рекомбинации до B), ДНК на участке гена RH полностью лишается гена RHD (C).Этот гаплотип (C) встречается примерно у 41% населения. Человек, гомозиготный по этому гаплотипу (около 17%), является D-отрицательным.
Молекулярная основа вариантов антигена D
Помимо отсутствия белка RhD, отрицательный фенотип D вызывается в основном серией изменений белка RhD, которые, в свою очередь, изменяют фенотип антигена D.
В зависимости от фенотипа и их молекулярной структуры эти аллели RHD классифицируются как частичный D, слабый D или DEL.
Частично D
Белок RhD несколько раз проходит через мембрану эритроцита, оставляя только часть белка открытой на поверхности (). Если аминокислота заменяется в части белка RhD, который расположен на внешней поверхности мембраны эритроцита, отдельные эпитопы антигена D могут быть потеряны или могут образоваться новые антигены. DNB — это самый распространенный европейский частичный D ().
Категории D представляют собой подгруппу частичного D. Структура генного сайта RH способствует преобразованию генов () 10 .В ген RHD будут вставлены некоторые гомологичные экзоны гена RHCE , образуя гибридный резус-аллель, который экспрессирует соответствующий гибридный белок. Так возникли категории D с III по VI. Изменения обычно затрагивают длинную цепочку аминокислот, которая всегда находится на поверхности эритроцита.
Категория DVI в результате преобразования гена Два гена RH лежат на своих хромосомах и указывают в противоположных направлениях (т. Е. Кластер).Когда хромосома складывается, два гена RH соседствуют, теперь указывая в одном направлении. Эта конфигурация обеспечивает преобразование гена в цис-форму, в результате чего сегмент ДНК переносится от одного гена к другому. Средний участок гена RHD (желтый) заменен соответствующим гомологичным участком гена RHCE (зеленый) (А). Этот тип генной конверсии отвечает за аллель RHD-CE ( 3–6) -D , который кодирует категорию D VI молекулярного типа 3 (DVI типа 3) (B).Экзоны с 1 по 10 нарисованы на обоих генах RH (C). Из-за противоположных направлений концевые экзоны двух генов RH ( RHD и RHCE экзон 10) расположены ближе всего друг к другу. В гене RHD экзоны с 3 по 6 заменены гомологичными экзонами гена RHCE .
Этот тип генной конверсии отвечает за аллель RHD-CE ( 3–6) -D , который кодирует категорию D VI молекулярного типа 3 (DVI типа 3) (B).Экзоны с 1 по 10 нарисованы на обоих генах RH (C). Из-за противоположных направлений концевые экзоны двух генов RH ( RHD и RHCE экзон 10) расположены ближе всего друг к другу. В гене RHD экзоны с 3 по 6 заменены гомологичными экзонами гена RHCE .
Слабый D
Если аминокислотная замена находится внутри мембраны эритроцита или цитоплазмы, это приведет к слабому фенотипу D () 11 .Интеграция белка RhD в мембрану будет затруднена, что приведет к количественному ослаблению D-антигена. Обычно нет качественных изменений и, следовательно, нет иммунизации против D. Слабый тип D 1 — самый распространенный в Европе ().
DEL
Особенно слабо экспрессируемый антиген D называется DEL (ранее Del), потому что его можно было продемонстрировать только с помощью элюции.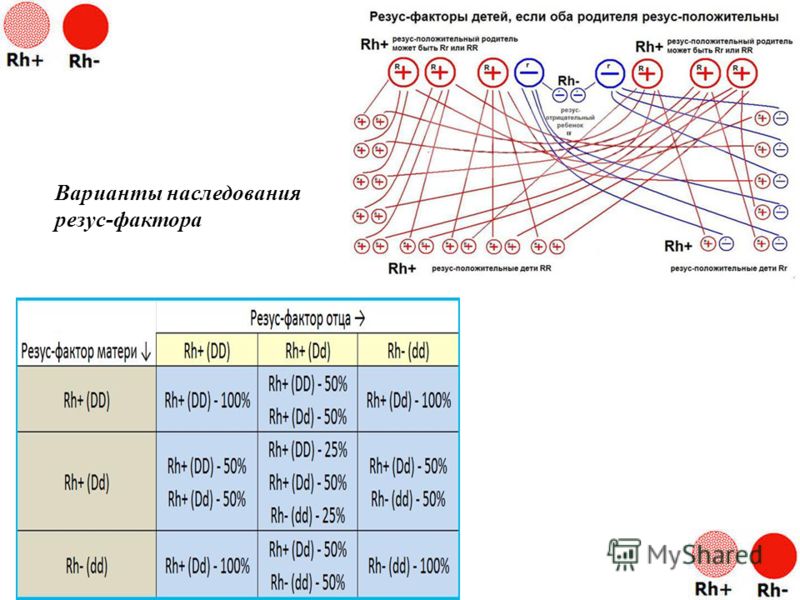 При элюции антитела отделяют от эритроцитов, чтобы продемонстрировать их в элюате. Молекулярные изменения более серьезны, чем наблюдаемые при слабом D, значительно затрудняя, но не полностью предотвращая интеграцию в клеточную мембрану.Все аллели DEL редки в Европе, но до 30% всех явно D-отрицательных особей в Восточной Азии являются носителями аллеля DEL RHD (K409K) 10 , 12 .
При элюции антитела отделяют от эритроцитов, чтобы продемонстрировать их в элюате. Молекулярные изменения более серьезны, чем наблюдаемые при слабом D, значительно затрудняя, но не полностью предотвращая интеграцию в клеточную мембрану.Все аллели DEL редки в Европе, но до 30% всех явно D-отрицательных особей в Восточной Азии являются носителями аллеля DEL RHD (K409K) 10 , 12 .
Антигены C / c и E / e
Клинически важные антигены резуса C, c, E и e являются результатом изменений белка RhCE только в пяти аминокислотных позициях (). Антигены называют антитезами, если белок может представлять только один из них. Они вызваны полиморфизмом белков.Часто существует два варианта белка, которые различаются только одним аминокислотным положением, например, резус-антигены E и e. RHCE Аллели , показывающие аминокислоту пролин в положении 226, экспрессируют E-антиген, тогда как RHCE аллели, показывающие аминокислоту аланин в этом положении, экспрессируют е-антиген () 1 . Сходные различия между двумя аллелями RHCE объясняют антитезные антигены C и c. Однако пары антигенов C / c и E / e не являются противоположными, поскольку они являются результатом замен в разных местах.Четыре возможных комбинации встречаются с разными частотами (у европейцев: Ce> ce> cE> CE) и наследуются как гаплотипы.
Сходные различия между двумя аллелями RHCE объясняют антитезные антигены C и c. Однако пары антигенов C / c и E / e не являются противоположными, поскольку они являются результатом замен в разных местах.Четыре возможных комбинации встречаются с разными частотами (у европейцев: Ce> ce> cE> CE) и наследуются как гаплотипы.
Клинические применения
Генетические исследования, как и все исследования в медицине, должны проводиться только в контексте четкой цели 13 . Что касается переливаний, молекулярно-биологические методы уже используются, чтобы дать рентабельные ответы на ряд клинически важных вопросов. Используемые методы включают полимеразную цепную реакцию (ПЦР) для амплификации гена и последующую идентификацию с помощью электрофореза, секвенирование нуклеотидов и гибридизацию на биочипах 14 .
Анти-D у пациентов
Встречаемые клинические проблемы вызваны небольшим количеством аллелей RHD . Пациенты обычно демонстрируют частичный D, в некоторых редких случаях слабый D, иммунизированный нормальным антигеном D.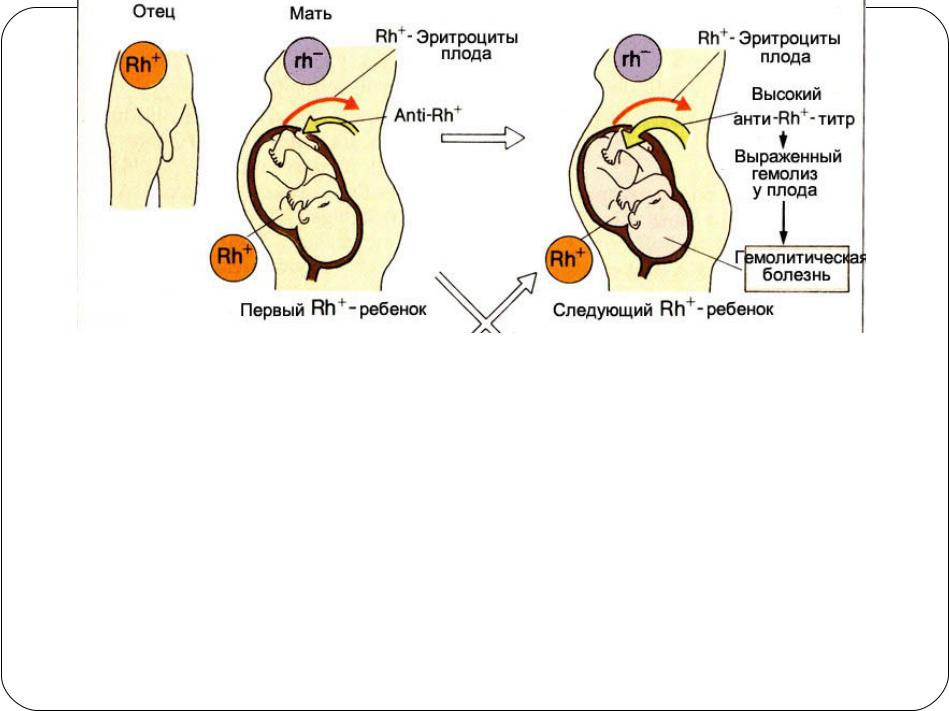 Поскольку категория VI (DVI) является наиболее важной из них, авторы рекомендуют использовать для типирования моноклональные анти-D антитела, которые не реагируют с DVI 15 , 16 .
Поскольку категория VI (DVI) является наиболее важной из них, авторы рекомендуют использовать для типирования моноклональные анти-D антитела, которые не реагируют с DVI 15 , 16 .
Эта процедура была включена в немецкие рекомендации по гемотерапии в 1996 году и с тех пор не менялась.Поэтому носителей DVI намеренно классифицируют как ложноотрицательные для предотвращения переливаний D-положительной крови и вероятной иммунизации против D 17 .
После того, как эти меры предосторожности были включены в немецкие директивы, они также были приняты другими европейскими странами. В отличие от частичного D, для слабого D типа 1, 2 или 3 18 еще не сообщалось об аллоиммунизации анти-D. С клинической точки зрения полезно, что здесь задействованы наиболее распространенные аллели D , которые составляют почти 90% всех слабых типов D в Германии 19 , поскольку эти пациенты могут получать переливания крови с положительным D-положительным результатом и не нуждаются в D-отрицательном результате.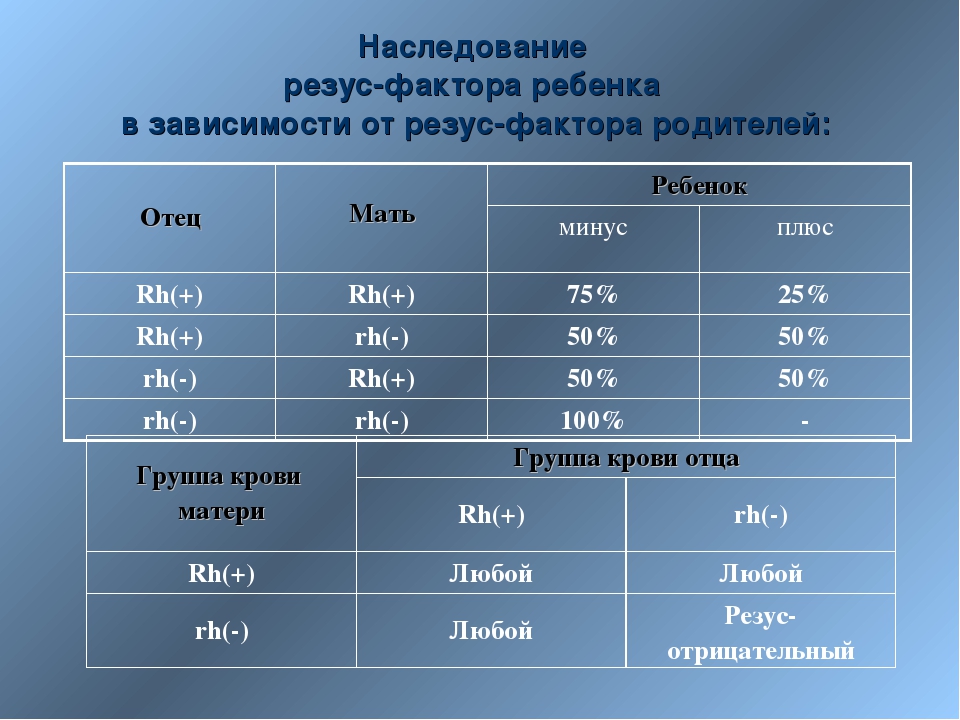 продукты.
продукты.
Эта процедура позволяет сэкономить до 5% всех продуктов D-отрицательных эритроцитов, так как они вполне могут быть заменены D-положительными продуктами 11 , что позволяет избежать узких мест в поставке продуктов крови D-отрицательных 20 .
Беременным женщинам и профилактика анти-D
Беременным женщинам со слабым типом D 1–3 также можно делать переливания крови с положительным результатом D, и профилактика анти-D не требуется. Ежегодно разовый генетический тест помогает избежать повторного введения анти-D 3500 беременным женщинам только в Германии (до 5% всех беременностей с отрицательным результатом D), а вместе с ним и всех возможных побочных эффектов этой профилактики, которые женщинам не требуется.Поэтому до 5% всех инъекций анти-D не нужны.
Одноразовый генетический тест более рентабелен, чем повторное введение анти-D продуктов. Чтобы реализовать этот подход, необходимо соответствующим образом адаптировать руководящие принципы оказания медицинской помощи во время беременности и после родов (рекомендации по материнству), выпущенные Федеральным комитетом врачей и фондов медицинского страхования [ Bundesausschuss der Ärzte und Krankenkassen ]. 21 . Все беременные женщины с редкими слабыми типами D будут получать необходимую профилактику, которую они не получат автоматически при текущем состоянии гемотерапии 5 и руководящих принципах по материнству 21 .
21 . Все беременные женщины с редкими слабыми типами D будут получать необходимую профилактику, которую они не получат автоматически при текущем состоянии гемотерапии 5 и руководящих принципах по материнству 21 .
Можно показать, что плод является D-положительным, демонстрируя ДНК плода в плазме периферической материнской крови 22 . В профилактике анти-D нет необходимости, если плод D-отрицательный. Это может сэкономить около 40% всей анти-D-профилактики, проводимой в настоящее время во время беременности. Этот метод был разработан в странах, граничащих с Германией, где ведутся активные усилия по внедрению этого подхода к генетической диагностике 23 .
Пренатальная диагностика
Если необходимо проверить плод на D-антиген, предпочтительным методом является амниоцентез или забор образцов из трофобласта 14 .Кордоцентез больше не проводится. Как уже упоминалось, в будущем можно будет использовать материнскую плазму.
Наличие ребенка и антитела к D
Если отец гетерозиготен по делеции RHD , существует 50% -ная вероятность того, что плод будет D-отрицательным, и в этом случае беременность практически не связана с гематологическим риском. Если отец гомозиготен по гену RHD , плод обязательно унаследует антиген D, который может повлиять на решение пары о том, иметь ребенка или нет.
В течение нескольких десятилетий было невозможно определить, является ли человек гетерозиготным или гомозиготным по RHD , потому что серологические методы не подходят. Однако с появлением генетической диагностики гибрида Rhesus box возможности значительно расширились. Если отец D-положительный, теперь достаточно проверить его на делецию RHD .
Использование при других заболеваниях
Если стандартные серологические методы не работают, генетическая диагностика является методом выбора для надежного определения группы крови пациентов после переливания крови и пациентов с ауто- или аллоиммунными гематологическими анемиями. Хотя перелитые лейкоциты могут при определенных обстоятельствах сохраняться годами, они не будут мешать рутинной генетической диагностике.
Хотя перелитые лейкоциты могут при определенных обстоятельствах сохраняться годами, они не будут мешать рутинной генетической диагностике.
Доноры крови
Соответствующее исследование гена RHD может идентифицировать явно D-отрицательных доноров, которые на самом деле являются слабыми D или DEL, таким образом гарантируя, что их кровь будет сдана только D-положительным реципиентам 18 . Без генетической диагностики реципиенты переливания крови с отрицательным результатом на D будут продолжать иммунизироваться антигеном D, содержащимся в такой крови 24 — 27 .
Доноры, которые до сих пор были ошибочно идентифицированы как D-отрицательные и чьи эритроциты являются химерами D- / D +, теперь могут быть идентифицированы правильно. Пожизненный химеризм может быть результатом монохориальной беременности двойней. Любое переливание крови из донорских источников, таких как эти, может привести к иммунизации против D, потому что они также содержат несколько миллилитров эритроцитов с совершенно нормальным D-положительным фенотипом. Эта D-положительная кровь может быть обнаружена только с помощью генетического исследования, а не с помощью обычных серологических методов 10 , 27 .Любой случай иммунизации против D имеет большое клиническое значение для девочек и женщин репродуктивного возраста. В случае беременности с положительным результатом D это может привести к резус-гемолитической болезни новорожденного.
Эта D-положительная кровь может быть обнаружена только с помощью генетического исследования, а не с помощью обычных серологических методов 10 , 27 .Любой случай иммунизации против D имеет большое клиническое значение для девочек и женщин репродуктивного возраста. В случае беременности с положительным результатом D это может привести к резус-гемолитической болезни новорожденного.
Функция белков резуса
Большинство белков группы крови имеют известную функцию. При очистке белков резуса человека американский врач Питер Агре обнаружил белок-переносчик воды 28 . Это открытие принесло ему Нобелевскую премию по химии 2003 года.Однако, несмотря на интенсивные усилия, для белков RhD и RhCE не было обнаружено никакой функции. Хотя резус-ассоциированный антиген (RhAG), гомолог резуса, содержащийся в эритроцитах, может переносить ионы аммония 29 , нельзя было показать, что сами резус-белки выполняют какую-либо такую функцию. Одна из возможных исследуемых функций включает обмен CO 2 и даже O 2 . Другая информация об аллелях RH будет получена только в результате повседневного клинического применения генетической диагностики, которая, таким образом, может способствовать определению их функции.
Одна из возможных исследуемых функций включает обмен CO 2 и даже O 2 . Другая информация об аллелях RH будет получена только в результате повседневного клинического применения генетической диагностики, которая, таким образом, может способствовать определению их функции.
С точки зрения фундаментальных исследований, в которые трансфузионная медицина будет продолжать вносить свой вклад, научная работа по резус 30 и другим группам крови была весьма продуктивной и еще не закончена.
Outlook
Генетическая диагностика используется для определения группы крови в клинической трансфузионной медицине с 2000 г. 31 , 32 . Как показала дородовая помощь, генетическое определение группы крови привело к повышению качества медицинской помощи, помогая избежать потенциальных побочных эффектов и сокращая расходы.Это редкая комбинация, которая оправдывает дополнительные затраты, связанные с оптимизацией ухода за счет использования методов генетической диагностики. Помимо улучшения ухода за пациентами, эти методы могут способствовать разработке новых методов 14 , которые также будут использоваться для здравоохранения за пределами Германии. Европейские отделения трансфузионной медицины лидируют в области молекулярной диагностики групп крови и ее приложений и будут продолжать вносить свой вклад в улучшение ухода за пациентами.
Помимо улучшения ухода за пациентами, эти методы могут способствовать разработке новых методов 14 , которые также будут использоваться для здравоохранения за пределами Германии. Европейские отделения трансфузионной медицины лидируют в области молекулярной диагностики групп крови и ее приложений и будут продолжать вносить свой вклад в улучшение ухода за пациентами.
Общие термины изменчивости генома
4 , 6SNP (однонуклеотидный полиморфизм)
Точечная мутация.Вариабельность нуклеотидной последовательности из-за изменения одного нуклеотида.
Аллель
Экспрессия кодирующей или некодирующей нуклеотидной последовательности (экзон или интрон гена) с двумя или более вариантами, часто отличающимися только точечной мутацией.
Генотип
Пара аллелей или вариантов нуклеотидной последовательности, встречающихся в гомологичных сайтах парных хромосом.
Гаплотип
Комбинация аллелей или вариантов нуклеотидной последовательности, расположенных близко друг к другу на одной хромосоме и обычно наследуемых вместе.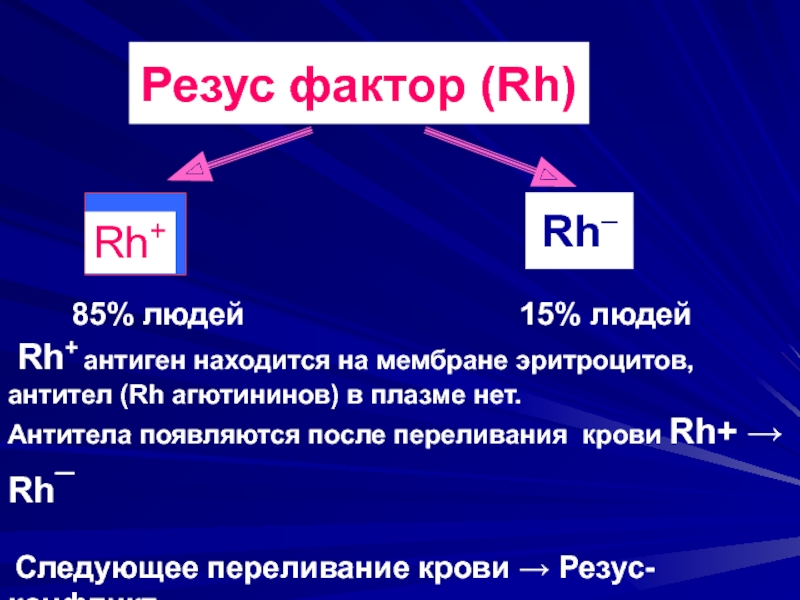
Миссенс-мутация
Аминокислотная замена в белке, вызванная точечной мутацией. Это может изменить функцию или антигенность белка.
Нонсенс-мутация
Стоп-кодон, вызванный точечной мутацией, которая преждевременно останавливает синтез аминокислотной цепи, что приводит к потере функции белка по его экспрессии.
Тихая мутация
Точечная мутация, которая не изменяет аминокислоту в сайте. Хотя белок не изменился, он все же может быть связан с клинически значимым фенотипом и использоваться в диагностике.
Мутация сдвига рамки
Потеря или вставка одного или двух нуклеотидов, которая сдвигает рамку считывания и преждевременно останавливает синтез белка (или удлиняет его в некоторых редких случаях), что приводит к потере функции или экспрессии белка.
Мутация сайта сплайсинга
Точечная мутация в сайте сплайсинга (соединение экзонинтрона), вызывающая ошибочное сплайсинг информационной РНК (мРНК) и пропуск экзона, что приводит к изменению аминокислотной последовательности.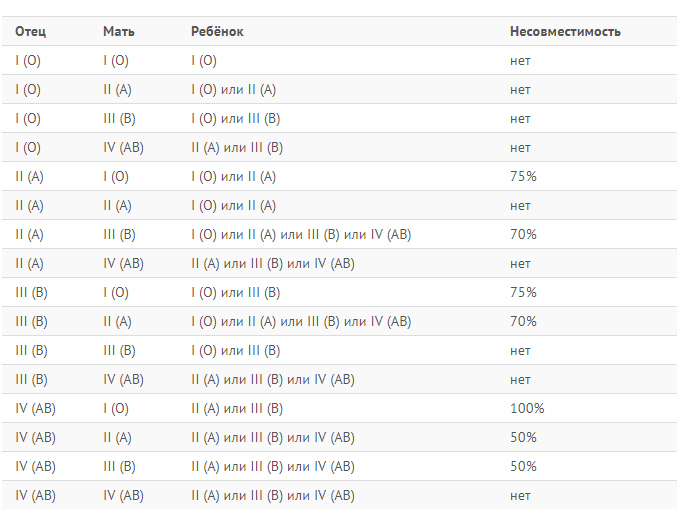 Приводит к потере функции или экспрессии белка.
Приводит к потере функции или экспрессии белка.
Преобразование гена
Невзаимный обмен между двумя или более гомологичными генами, при котором определенная нуклеотидная последовательность в гене заменяется последовательностью в другом гене, который расположен на той же хромосоме (преобразование в цис).
Благодарности
Эта статья опубликована с разрешения Кристофера Бетге, доктора медицины, главного редактора журнала Deutsches Ärzteblatt . Этот английский перевод предоставлен журналом Deutsches Ärzteblatt .
Сноски
* Часть этого обзора была представлена автором на XXXIX Конгрессе SIMTI (Пестум, Южная Америка, 4-7 октября 2006 г.)
Ссылки
1. Флегель В.А., Вагнер Ф.Ф. Blutgruppen: Alloantigene auf Erythrozyten. В: Мюллер-Экхардт C, Кифель V, редакторы. Трансфузиимедизин. Берлин: Берлин-Спрингер; 2003. С. 145–85. [Google Scholar] 2. Ховард Х., Мартлью В., Макфадьен И. и др. Последствия аллоиммунизации материнских эритроцитов для плода и новорожденного. Arch Dis Child Fetal Neonatal Ed. 1998; 78: F62–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Филби Д., Хэнсон У., Уэстром Дж. Распространенность антител к эритроцитам во время беременности коррелировала с исходом новорожденного: 12-летнее исследование в центральной Швеции. Acta Obstet Gynecol Scand. 1995; 74: 687–92. [PubMed] [Google Scholar] 4. Cheong YC, Goodrick J, Kyle PM, Soothill P. Управление антителами против резуса-D во время беременности: обзор с 1994 по 1998 год. Fetal Diagn Ther. 2001; 16: 294–8. [PubMed] [Google Scholar] 5.Bundesärztekammer, Paul-Ehrlich-Institut Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie) –Gesamtnovelle 2005. Bundesanzeiger. 2005. 57 (209a): 4–35. [Google Scholar] 6. Cichon S, Freudenberg J, Propping P, Nöthen MM. Variabilität im menschlichen Genom. Dtsch Arztebl. 2002; 99: 3091–101. [Google Scholar] 7. Вагнер Ф. Ф., Эйхер Н. И., Йоргенсен Дж. Р. и др. DNB: частичное D с анти-D, часто встречающееся в Центральной Европе.
Arch Dis Child Fetal Neonatal Ed. 1998; 78: F62–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Филби Д., Хэнсон У., Уэстром Дж. Распространенность антител к эритроцитам во время беременности коррелировала с исходом новорожденного: 12-летнее исследование в центральной Швеции. Acta Obstet Gynecol Scand. 1995; 74: 687–92. [PubMed] [Google Scholar] 4. Cheong YC, Goodrick J, Kyle PM, Soothill P. Управление антителами против резуса-D во время беременности: обзор с 1994 по 1998 год. Fetal Diagn Ther. 2001; 16: 294–8. [PubMed] [Google Scholar] 5.Bundesärztekammer, Paul-Ehrlich-Institut Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie) –Gesamtnovelle 2005. Bundesanzeiger. 2005. 57 (209a): 4–35. [Google Scholar] 6. Cichon S, Freudenberg J, Propping P, Nöthen MM. Variabilität im menschlichen Genom. Dtsch Arztebl. 2002; 99: 3091–101. [Google Scholar] 7. Вагнер Ф. Ф., Эйхер Н. И., Йоргенсен Дж. Р. и др. DNB: частичное D с анти-D, часто встречающееся в Центральной Европе. Кровь. 2002; 100: 2253–6. [PubMed] [Google Scholar] 8.Вагнер Ф. Ф., Флегель В. А.. RHCE представляет собой предковую позицию RH , тогда как RHD представляет собой дублированный ген. Кровь. 2002; 99: 2272–3. [PubMed] [Google Scholar] 9. Вагнер Ф. Ф., Флегель В. А.. Делеция гена RHD произошла в резус-боксе . Кровь. 2000; 95: 3662–8. [PubMed] [Google Scholar] 11. Вагнер Ф.Ф., Гасснер С., Мюллер Т.Х. и др. Молекулярная основа слабых D-фенотипов. Кровь. 1999; 93: 385–93. [PubMed] [Google Scholar] 12. Шао С.П., Маас Дж. Х., Су YQ и др.Молекулярный фон Rh D-положительных, D-отрицательных, D (el) и слабых D фенотипов у китайцев. Vox Sang. 2002; 83: 156–61. [PubMed] [Google Scholar] 13. Propping P. Genetische Diagnostik vor dem Hintergrund von Millionen Polymorphismen. Dtsch Arztebl. 2004. 101: 3100–1. [Google Scholar] 14. Флегель В.А., Вагнер Ф.Ф., Мюллер Т.Х., Гасснер К. Предсказание фенотипа Rh путем типирования ДНК и его применение на практике.
Кровь. 2002; 100: 2253–6. [PubMed] [Google Scholar] 8.Вагнер Ф. Ф., Флегель В. А.. RHCE представляет собой предковую позицию RH , тогда как RHD представляет собой дублированный ген. Кровь. 2002; 99: 2272–3. [PubMed] [Google Scholar] 9. Вагнер Ф. Ф., Флегель В. А.. Делеция гена RHD произошла в резус-боксе . Кровь. 2000; 95: 3662–8. [PubMed] [Google Scholar] 11. Вагнер Ф.Ф., Гасснер С., Мюллер Т.Х. и др. Молекулярная основа слабых D-фенотипов. Кровь. 1999; 93: 385–93. [PubMed] [Google Scholar] 12. Шао С.П., Маас Дж. Х., Су YQ и др.Молекулярный фон Rh D-положительных, D-отрицательных, D (el) и слабых D фенотипов у китайцев. Vox Sang. 2002; 83: 156–61. [PubMed] [Google Scholar] 13. Propping P. Genetische Diagnostik vor dem Hintergrund von Millionen Polymorphismen. Dtsch Arztebl. 2004. 101: 3100–1. [Google Scholar] 14. Флегель В.А., Вагнер Ф.Ф., Мюллер Т.Х., Гасснер К. Предсказание фенотипа Rh путем типирования ДНК и его применение на практике. Transfus Med. 1998. 8: 281–302. [PubMed] [Google Scholar] 15. Вагнер Ф. Ф., Касульке Д., Кероуган М., Флегель В. А..Частоты групп крови ABO, резус, D категории VI, Kell и клинически значимых высокочастотных антигенов в Юго-Западной Германии. Infusionsther Transfusionsmed. 1995; 22: 285–90. [PubMed] [Google Scholar] 16. Вагнер Ф.Ф., Гасснер С., Мюллер Т.Х. и др. Три молекулярные структуры вызывают фенотипы резуса D категории VI с отчетливыми иммуногематологическими особенностями. Кровь. 1998. 91: 2157–68. [PubMed] [Google Scholar] 17. Липперт H-D, Флегель WA. Kommentar zum Transfusionsgesetz (TFG) und den Hämotherapie-Richtlinien.Гейдельберг: Спрингер; 2002. [Google Scholar] 18. Флегель WA. Как я веду доноров и пациентов со слабым фенотипом D. Curr Opin Hematol. 2006; 13: 476–83. [PubMed] [Google Scholar] 19. Wagner FF, Frohmajer A, Ladewig B и др. Слабые аллели D выражают разные фенотипы. Кровь. 2000; 95: 2699–708. [PubMed] [Google Scholar] 20. Гарратти Г. Нужно ли нам больше беспокоиться о слабых антигенах D? Переливание.
Transfus Med. 1998. 8: 281–302. [PubMed] [Google Scholar] 15. Вагнер Ф. Ф., Касульке Д., Кероуган М., Флегель В. А..Частоты групп крови ABO, резус, D категории VI, Kell и клинически значимых высокочастотных антигенов в Юго-Западной Германии. Infusionsther Transfusionsmed. 1995; 22: 285–90. [PubMed] [Google Scholar] 16. Вагнер Ф.Ф., Гасснер С., Мюллер Т.Х. и др. Три молекулярные структуры вызывают фенотипы резуса D категории VI с отчетливыми иммуногематологическими особенностями. Кровь. 1998. 91: 2157–68. [PubMed] [Google Scholar] 17. Липперт H-D, Флегель WA. Kommentar zum Transfusionsgesetz (TFG) und den Hämotherapie-Richtlinien.Гейдельберг: Спрингер; 2002. [Google Scholar] 18. Флегель WA. Как я веду доноров и пациентов со слабым фенотипом D. Curr Opin Hematol. 2006; 13: 476–83. [PubMed] [Google Scholar] 19. Wagner FF, Frohmajer A, Ladewig B и др. Слабые аллели D выражают разные фенотипы. Кровь. 2000; 95: 2699–708. [PubMed] [Google Scholar] 20. Гарратти Г. Нужно ли нам больше беспокоиться о слабых антигенах D? Переливание. 2005; 45: 1547–51. [PubMed] [Google Scholar]
2005; 45: 1547–51. [PubMed] [Google Scholar]21. Gemeinsamer Bundesausschuss. Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die ärztliche Betreuung während der Schwangerschaft und nach der Entbindung.Bundesanzeiger 1986; 60 a (Beilage), zuletzt geändert: Bundesanzeiger 2003; 126 : 14.906.
22. Lo YMD, Hjelm NM, Fidler C, et al. Пренатальная диагностика RhD-статуса у плода с помощью молекулярного анализа материнской плазмы. N Engl J Med. 1998; 339: 1734–8. [PubMed] [Google Scholar] 23. Bianchi DW, Avent ND, Costa JM, van der Schoot CE. Неинвазивная пренатальная диагностика резуса D плода: готово к первому (r) времени. Obstet Gynecol. 2005; 106: 841–4. [PubMed] [Google Scholar] 24. Wagner T, Körmöczi GF, Buchta C, et al.Иммунизация анти-D эритроцитами DEL. Переливание. 2005. 45: 520–6. [PubMed] [Google Scholar] 25. Гасснер С., Дошер А., Дрновшек Т.Д. и др. Присутствие RHD у серологически D-, C / E + индивидуумов: европейское многоцентровое исследование. Переливание. 2005; 45: 527–38. [PubMed] [Google Scholar] 26. Ясуда Х., Ото Х., Сакума С., Исикава Ю. Вторичная иммунизация анти-D эритроцитами DEL. Переливание. 2005; 45: 1581–4. [PubMed] [Google Scholar] 27. Флегель WA. Иммуногенность D-антигена. Переливание.2005; 45: 466–8. [PubMed] [Google Scholar] 28. Агре П., Сабури А.М., Асимос А., Смит Б.Л. Очистка и частичная характеристика интегрального мембранного белка Mr 30,000, связанного с эритроцитарным антигеном Rh (D). J Biol Chem. 1987; 262: 17497–503. [PubMed] [Google Scholar] 29. Марини А.М., Матасси Дж., Рейнал В. и др. Связанный с резусом белок RhAG человека и его гомолог почек способствуют транспорту аммония в дрожжах. Нат Жене. 2000; 26: 341–4. [PubMed] [Google Scholar] 31. Müller TH, Hallensleben M, Schunter F, Blasczyk R.Molekulargenetische Blutgruppendiagnostik. Dtsch Arztebl. 2001; 98: A317–22. [Google Scholar] 32. Northoff H, Флегель WA. Генотипирование и фенотипирование: две стороны одной медали. Infusionsther Transfusionsmed.
Переливание. 2005; 45: 527–38. [PubMed] [Google Scholar] 26. Ясуда Х., Ото Х., Сакума С., Исикава Ю. Вторичная иммунизация анти-D эритроцитами DEL. Переливание. 2005; 45: 1581–4. [PubMed] [Google Scholar] 27. Флегель WA. Иммуногенность D-антигена. Переливание.2005; 45: 466–8. [PubMed] [Google Scholar] 28. Агре П., Сабури А.М., Асимос А., Смит Б.Л. Очистка и частичная характеристика интегрального мембранного белка Mr 30,000, связанного с эритроцитарным антигеном Rh (D). J Biol Chem. 1987; 262: 17497–503. [PubMed] [Google Scholar] 29. Марини А.М., Матасси Дж., Рейнал В. и др. Связанный с резусом белок RhAG человека и его гомолог почек способствуют транспорту аммония в дрожжах. Нат Жене. 2000; 26: 341–4. [PubMed] [Google Scholar] 31. Müller TH, Hallensleben M, Schunter F, Blasczyk R.Molekulargenetische Blutgruppendiagnostik. Dtsch Arztebl. 2001; 98: A317–22. [Google Scholar] 32. Northoff H, Флегель WA. Генотипирование и фенотипирование: две стороны одной медали. Infusionsther Transfusionsmed.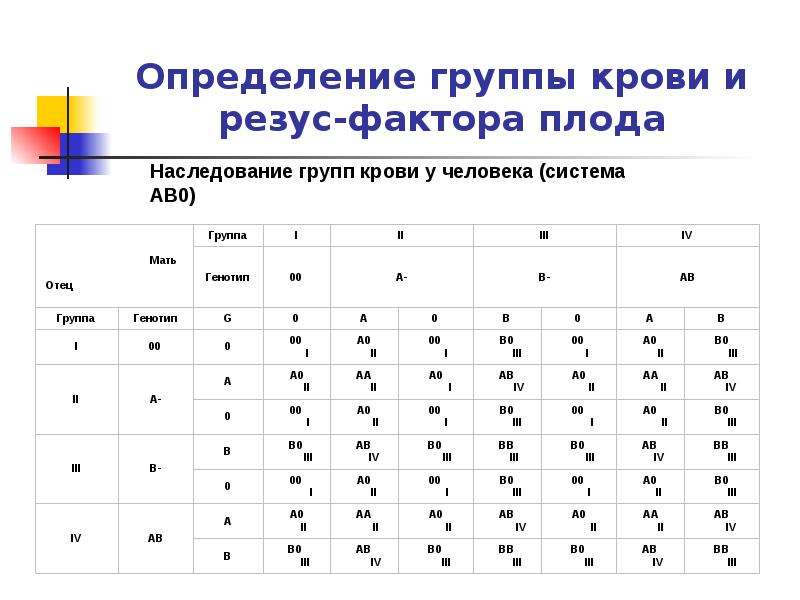 1999; 26: 5. [Google Scholar]
1999; 26: 5. [Google Scholar]Как, почему … и почему нет
Независимо от того, окажется ли «Ева» первым живым клоном человека, пятничное сообщение о ее рождении подлило масла в и без того бушующую научную и политическую полемику. Вот некоторые из основных вопросов и ответов о клонировании человека и о том, что его ждет впереди.
Что такое клонирование?
Клонирование — это процесс создания нового организма путем копирования генетической информации от единственного «родительского» организма.
В некотором смысле однояйцевые близнецы могут считаться клонами друг друга, но сегодня этот термин чаще всего применяется к методике, называемой «перенос ядра». В этом процессе ядро яйца (которое имеет половину хромосом для нового человека) удаляется и заменяется ядром из клетки-донора (которое имеет полный набор хромосом).Затем химическая ванна или поражение электрическим током вызывают искрение клетки, чтобы начать деление.
При «терапевтическом клонировании» клонированные клетки собирают вскоре после того, как они начинают делиться, когда было создано лишь несколько новых клеток. Многие исследователи считают, что клетки, полученные с помощью этого метода, можно использовать для выращивания новых тканей для трансплантации органов и для лечения таких заболеваний, как болезнь Паркинсона и Альцгеймера.
Многие исследователи считают, что клетки, полученные с помощью этого метода, можно использовать для выращивания новых тканей для трансплантации органов и для лечения таких заболеваний, как болезнь Паркинсона и Альцгеймера.
При «репродуктивном клонировании» развивающийся эмбрион имплантируется в утробу женщины и дается возможность вырасти.Это то, что ученые из фонда Clonaid утверждают, что впервые в истории сделали, используя яйцо, а также ядро, пожертвованное матерью, для создания клонированного ребенка под кодовым названием «Ева».
Различие между терапевтическим и репродуктивным клонированием имеет решающее значение для понимания дискуссии о науке, этике и политике процедуры. Щелкните интерактивную ссылку ниже, чтобы узнать больше об этом процессе.
Является ли клон точной копией оригинала?
Клонированное потомство имеет генетический план оригинала, содержащийся в ядерной ДНК, но ученые говорят, что другие факторы сделают клон отличным от его родителя.
Митохондриальная ДНК, которая служит топливной фабрикой для каждой живой клетки, будет происходить из донорской яйцеклетки, а не из имплантированного ядра. Гормональные влияния суррогатной матери могут вызвать различия в развитии. Кроме того, некоторые физические характеристики, такие как рисунок вашего отпечатка пальца, определяются случайными комбинациями во время внутриутробного развития. (Вот почему даже у однояйцевых близнецов разные отпечатки пальцев.)
Почему ученые так скептически относятся к этим заявлениям?
Начнем с того, что клонирование — непростая задача, — говорит д-р.Ян Смит, медицинский корреспондент NBC.
«Это требует правильного уровня навыков, правильных технологий, и во многих случаях требуется много удачи», — сказал он.
Исследователи и спонсоры Clonaid не пользуются большим доверием у научного сообщества, отчасти потому, что они были связаны с сектой космических пришельцев, известной как раэлианцы.
Самый известный ученый компании, Брижит Буасселье, не имеет большого опыта в этой области и хранит практически все детали проекта в секрете.
Как мы узнаем, действительно ли Ева клон?
Клонайд, похоже, хочет позволить независимой группе экспертов подтвердить, что Ева — клон, используя генетические тесты. Кто-то, желающий совершить розыгрыш, должен фальсифицировать анализ — например, предоставив два образца крови, взятых у матери, и заявив, что один из образцов был взят у ребенка.
Ева также может оказаться естественным ребенком своей матери и «бесплодного» отца. В прошлом предполагаемые бесплодные пары, проходящие процесс экстракорпорального оплодотворения, были удивлены, узнав, что их потомство на самом деле было зачато старомодным способом.
Независимый научный журналист Майкл Гиллен отвечает за организацию процедуры независимого тестирования для проверки генетического статуса Евы.
«Если Майкл находится в комнате, когда берется кровь, и он наблюдает за доставкой этой крови различным научным группам, у меня не будет никаких вопросов», — сказал доктор Роберт Ланза, исследователь клонирования, который является вице-президентом медицинские и научные разработки в Advanced Cell Technology. «Пока выполняются условия Майкла, для всех команд было бы невозможно самостоятельно прийти к неверному выводу.”
Как мы дошли до этого момента?
Клонирование было предметом научной фантастики до 1997 года, когда британские исследователи создали клонированную овцу по имени Долли.
За прошедшие с тех пор годы крупный рогатый скот, кошек, свиней и мышей клонировали с помощью метода переноса ядер, а обезьяну-резус «клонировали» с помощью менее сложного процесса, известного как расщепление эмбриона.
Исследования клонирования человеческих эмбрионов были продиктованы в первую очередь потенциальными преимуществами клонированной ткани для лечения болезней, и ведущие научные круги пытались воспрепятствовать работе по репродуктивному клонированию.Лишь несколько исследователей на периферии пытались произвести на свет детей.
Опасно ли клонирование человека?
Помимо чисто метафизических и этических вопросов, есть еще вопросы безопасности. В эксперименте, который привел к созданию Долли, потребовалось 277 попыток, чтобы получить одну успешно клонированную овцу. Ланца сказал, что шансы на успех выглядят несколько лучше, если вы посмотрите только на клонированные эмбрионы животных, которые признаны достойными имплантации в матку. Тем не менее, по его словам, только около 50 процентов имплантированных эмбрионов животных приводили к беременности, и только один или два из каждых 10 эмбрионов вынашивались.По словам Ланцы, опубликованные исследования показывают, что от 25 до 30 процентов родившихся животных страдали аномалиями.
С какими проблемами столкнулись клонированные животные?
Ланца сказал, что у клонированных потомков обнаружились десятки проблем со здоровьем, включая ожирение, судороги, опухоли, серьезные сердечно-сосудистые проблемы, проблемы с тимусом и проблемы с суставами.
Многие проблемы не проявляются при рождении, и не хватает истории болезни, чтобы определить весь спектр болезней, которые могут возникнуть в течение жизни клона.
Ученые подозревают, что проблемы связаны с отклонениями в экспрессии генов, возникающими в процессе клонирования. Некоторые исследователи сообщили, что клетки клонированных животных имеют более короткие теломеры — фрагменты ДНК на концах хромосом, которые связаны с процессом клеточного старения. Они предполагают, что теломеры могут играть ключевую роль в проблемах со здоровьем клонированных животных, но другие исследователи не уверены в этом.
Зачем кому-то нужен клонированный ребенок?
Клонайд говорит, что мать Евы — 31-летняя американка, которая прошла процесс клонирования, потому что ее муж бесплоден.Организация заявляет, что другие клиенты пытаются завести детей, которые будут генетически соответствовать детям, которых они потеряли. Между тем раэлицы верят, что люди могут достичь своего рода бессмертия, клонируя себя, а затем каким-то образом передавая свое сознание от одного поколения к другому.
Собираются ли США запретить клонирование человека?
В прошлом году Палата представителей приняла законопроект, направленный на запрет терапевтического, а также репродуктивного клонирования человека, но принятие этой меры было приостановлено в Сенате, возглавляемом демократами.
Сенат теперь переходит под контроль республиканцев, и новым лидером большинства стал Билл Фрист, врач из Теннесси, выступающий против обеих разновидностей клонирования человека. Фрист утверждает, что исследователям не нужно прибегать к клонированию для исследования эмбриональных стволовых клеток.
Консультативная группа администрации Буша по биоэтике рекомендовала запретить репродуктивное клонирование человека и ввести четырехлетний мораторий на терапевтическое клонирование, что, по мнению многих исследователей в этой области, фактически равносильно запрету.
В пятницу Белый дом заявил, что он «глубоко обеспокоен» заявлением Клонайда, а Фрист, по словам Фриста, сказал, что это объявление «должно служить пугающим напоминанием о том, что люди все еще пытаются клонировать людей».
Наблюдатели с обеих сторон по вопросу о клонировании ожидают возобновления политического толчка в отношении законодательства по борьбе с клонированием во время следующей сессии Конгресса.
Кто-нибудь еще пытается клонировать людей?
Итальянский врач-репродуктолог Северино Антинори прогнозирует, что его отдельный проект приведет к рождению клонированного мальчика в январе.
Advanced Cell Technology, компания из Массачусетса, где Ланза проводит свои исследования, была единственной американской лабораторией, открыто участвующей в терапевтическом клонировании человека. Стэнфордский университет объявил в этом месяце, что будет проводить исследования в области технологии передачи ядер, но отказался от ярлыка «клонирование».
Ряд лабораторий за пределами Соединенных Штатов участвует в терапевтических исследованиях клонирования человека, что вызывает опасения среди некоторых ученых, что U.Исследовательские учреждения С. могут потерять свое преимущество в биомедицинской сфере. В нескольких странах, в том числе в Великобритании, приняты законы, запрещающие клонирование человека в целях воспроизводства, но разрешающие клонирование в лечебных целях.
Эта статья была обновлена, чтобы дать лучшее определение теломер и их роли в клетках.
Сдвиг от резус-положительного к резус-отрицательному фенотипу, вызванный соматической мутацией в гене RHD у пациента с хроническим миелоцитарным лейкозом — CHÉrif-Zahar — 1998 — British Journal of Hematology
Аномальная экспрессия антигенов группы крови при заболевании признан давно.Первый представленный пример касался системы ABH и связанных с ней изменений антигенов при гематологических нарушениях, таких как лейкемия и миелопролиферативные заболевания (обзоры см. В 41; 20), и при солидных опухолях ( 27; 24; 26). Реже меняется группа крови резус-фактора, характеризующаяся наличием двух популяций эритроцитов разного резус-фенотипа (резус-мозаицизм) в крови пациентов, страдающих острым и хроническим миелогенным лейкозом (ОМЛ, ХМЛ), миелоидной метаплазией, полицитемией или миелофиброзом. , были описаны ( 44; 29; 31; 32; 5; 23; 18; 46).У пациента с ХМЛ были затронуты локусы RH и MNS ( 4). В нескольких случаях наблюдалась полная потеря резус-антигенов ( 33, 34; 12; 19; 36; 35). Хотя в некоторых случаях наблюдалась связь потери резуса с хромосомными аберрациями ( 33; 12; 36), в других случаях не было замечено никаких обнаруживаемых аномалий хромосомы 1, где расположен локус RH (1p34-p36). В этих примерах резус-мозаицизм, скорее всего, привел к распространению аномального клона стволовых клеток (соматическая мутация, моносомия по RH?), Который иногда исчезал во время клинической ремиссии с возвращением к нормальному резус-фенотипу ( 4; 36).Однако неясно, вызваны ли эти изменения в экспрессии группы крови резус самим лейкемическим процессом. Мозаицизм Rh был также обнаружен у практически здоровых людей, у которых химеризм или диспермия могли быть устранены в качестве возможного объяснения ( 39; 35; 40). В одном случае подозревалась соматическая мутация, затрагивающая только одного из монозиготных близнецов ( 37). У здорового донора и пациента, страдающего негематологическим заболеванием (выпадение межпозвоночного диска), соответственно, отмечен мозаицизм по локусу группы крови RH и FY (хромосома 1q) ( 28; 38).
Молекулярные изменения группы крови ABH и ассоциированных антигенов лучше всего исследовали на карциномах (25), но изменения, если таковые имеются, продуктов первичного гена, гликозилтрансфераз, до сих пор неизвестны. Точно так же в настоящее время нет доступной информации о молекулярных изменениях, вызывающих изменения группы крови резус при злокачественных заболеваниях, хотя молекулярная основа генов RH в значительной степени определена (обзоры см. 7; 1; 6).
В этом отчете мы показываем, что потеря антигена RhD у пациента, страдающего хроническим миелоидным лейкозом, была результатом соматической мутации в гене RHD (делеция одного нуклеотида), которая повлияла на эритроид, но не на лимфоидную линию.
МЕТОДЫ
Образцы крови
Образец крови пациента был взят в больнице Ольборга (Дания) и отправлен на анализ в Париж в июне 1994 года.После информированного согласия у пациента была получена линия B-лимфобластоидных клеток, как описано ранее (21). Образцы крови от распространенных RhD-положительных (DCCee и DCcee) и RhD-отрицательных (ddccee и ddCee) фенотипов были получены из Национального института переливания крови в Париже.
Проточная цитометрия
Иммуноокрашивание интактных эритроцитов проводили, как описано (43), с использованием мышиных моноклональных антител, направленных против CD47 (MAb 6H9, предоставлено доктором М.Телен, Дарем, Северная Каролина), LW (BS46, предоставлен доктором Х. Х. Зоннеборном, Драйрих, Германия) и гликопротеином Rh50 (2D10, подарком доктора А. фон дем Борне, Амстердам, Нидерланды). Использовали конъюгированные с флуоресцеином фрагменты F (ab ‘) 2 козьего антимышиного IgG (Immunotech, Марсель, Франция) и определяли среднюю интенсивность флуоресценции с помощью проточного цитометра FACScan (Becton Dickinson, Сан-Хосе, Калифорния). Определение плотности антигенных сайтов проводили с помощью микрогранул QIFIKIT, покрытых различным количеством молекул мышиного Ig (Biocytex, Марсель, Франция).
Саузерн-блоттинг
Геномная ДНК человека, выделенная из периферических лейкоцитов, была расщеплена рестрикционным ферментом Hin dIII (10 Ед / мкг ДНК), разделена электрофорезом в 0,8% агарозном геле и перенесена методом Саузерна на нейлоновую мембрану Zeta probe GT (Biorad, Richmond, Калифорния), как описано ранее ( 42). Гибридизация с зондом кДНК RhIXb ( 8) (10 6 имп / мин / мл) выполняли в течение 16 ч при 65 ° C в 7% додецилсульфате натрия (SDS), 0.5 М NaHPO 4 . Заключительные отмывки выполняли при 65 ° C в течение 45 минут в 5% SDS, 40 мкм. M NaHPO 4 и в течение 30 мин в 1% SDS, 40 м М NaHPO 4 .
Двухфазная жидкая культура предшественников эритроидов
Мононуклеарные клетки периферической крови пациента были отделены центрифугированием в градиенте плотности Ficoll-Paque (Pharmacia, Uppsala, Sweden) и культивированы в двухфазной жидкой культуральной системе, как описано (16, 17; 47) со следующими изменениями.Эпо-независимую фазу проводили при плотности 10 6 клеток / мл в модифицированной среде Дульбекко Искова (IMDM, GIBCO BRL, Eragny, Франция) с добавлением 10% фетальной телячьей сыворотки (FCS, GIBCO), 50 нг стволовых клеток. фактор (PeproTech. Inc., Rock Hill, NJ), 2 нг / мл рекомбинантного IL-3 (PeproTech) и 1 мкг / мл циклоспорина A в течение 6 дней при 37 ° C в атмосфере 5% CO 2 . Эпо-зависимую фазу проводили путем рекультивирования нефагоцитарных клеток (0,5–1 × 10 6 клеток / мл) в IMDM, содержащем 30% FCS, 1% деионизированного BSA, 10.5 моль / л меркаптоэтанола, 1,5 ммоль / л глутамина, 300 мкг / мл насыщенного железом трансферрина и 2 ед. / Мл человеческого рекомбинантного Epo (INTS, Париж, Франция) в течение 8–10 дней при 37 ° C в 5% CO 2 и 5% O 2 атмосфер.
Созревание эритроидов в культуре контролировали с помощью проточной цитометрии (FacScan, Becton Dickinson) с использованием конъюгированных с фикоэритрином мышиных моноклональных антител к гликофорину A (GPA) и окрашиванию тиазоловым оранжевым (TO) (Retic-COUNT, Becton Dickinson).Мертвые клетки и обломки были исключены путем установки ворот на точечной диаграмме FSC v SSC. С помощью анализа GPA v TO окрашивания были установлены три точки входа: GPA + TO — (зрелые эритроциты), GPA + TO + (ретикулоциты) и GPA + TO ++ (ядросодержащие ячеек).
Обратная транскрипция в сочетании с ПЦР-амплификацией
РНК ретикулоцитов из 30 мл периферической крови выделяли путем селективного лизирования эритроцитов по реакции Орскова (22).1 мкг РНК подвергали обратной транскрипции в общем объеме 33 мкл с использованием набора для синтеза первой цепи кДНК (Pharmacia) в соответствии с инструкциями производителя. Затем 5 мкл продуктов кДНК подвергали ПЦР через 50 мин. М КС1, 10 м М Трис (pH 8,3), 1,5 м M MgCl 2 , 0,01% желатин, 0,2 м M четырех дНТФ, 50 пмоль каждого праймера и 2,5 единицы полимеразы Taq (Perkin-Elmer-Cetus, Norwalk, США). Используемые праймеры описаны в Таблица I. Условия ПЦР: денатурация 5 мин при 94 ° C (первый цикл) и 1 мин при 94 ° C, отжиг 1 мин при 55 ° C, удлинение 1 мин 30 с при 72 ° C, 30 циклов.Соответствующие фрагменты ПЦР очищали на 1% агарозном геле с низкой температурой плавления с последующим использованием мини-колонок для ПЦР Wizard TM (Promega, Мэдисон, Висконсин) и субклонировали в вектор PCR TM II с использованием набора для клонирования TA (Invitrogen, Нидерланды).
Анализ геномной ДНК
ПЦР-амплификациюпроводили на геномной ДНК, выделенной из общих лейкоцитов или из препарата чистых нейтрофилов, выделенных из периферической крови, а также из культур предшественников эритроидов пациента.Первоначальный анализ генов RH был выполнен в Aalborg с использованием праймеров, специфичных для последовательности для Rhc и RhD ( 3; 30). Фрагмент 728 п.н., охватывающий последовательности экзона 4 — экзон 5 гена RHD , был получен с использованием праймеров P6 и P7 ( Таблица I) после 30 циклов следующим образом: 1 мин при 94 ° C, 30 с при 50 ° C и 30 с при 72 ° C. Продукт ПЦР очищали с помощью ультрафильтрационной мембраны с микроконцентрацией (Amicon) и клонировали в вектор PCR TM II.
Таблица 1. Таблица I. Последовательность и положение праймеров.- † nt +1 представляет собой A инициирующего кодона ATG кДНК.
Секвенирование ДНК
Секвенирование выполняли на автоматическом экспресс-секвенаторе ALF (Pharmacia) с использованием набора для секвенирования Thermo Sequence (Amersham International, Bucks., Великобритания) в соответствии с инструкциями производителя.
Филадельфийский хромосомный анализ
Это было выполнено в апреле 1994 г. методом саузерн-блоттинга с использованием специфического зонда (phl-bcr3), распространяемого Oncogen Science Inc. (Нью-Йорк, США). Вкратце, геномные фрагменты Bgl II размером 4,8, 2,3 и 1,1 т.п.н. были обнаружены в дополнение к одной или двум дополнительным полосам, как это наблюдается у большого числа пациентов с ХМЛ. Повторный анализ хромосомы Филадельфии (Ph 1 ) был проведен в сентябре 1997 года с помощью мультиплексной ПЦР с кДНК, обратно транскрибированной из РНК лейкоцитов периферической крови, используемых в качестве матрицы, как описано ( 13).
РЕЗУЛЬТАТЫ
История болезни
Пациентка, 69-летняя женщина европеоидной расы, была госпитализирована в местную больницу в 1979 г. для лечения рака правой груди с мастэктомией. Результат стандартного определения группы крови, проведенного в Ольборге, был O, c +, D +, E- (RhD-положительный). В 1989 г. местный рецидив рака груди лечили хирургическим путем. В 1991 году пациентка была госпитализирована в амбулаторное отделение онкологического отделения больницы Ольборга, где группа крови была определена как O, RhD-положительная.В 1992 году она была госпитализирована в местную больницу, где диагностировали рак левой груди и лечили мастэктомией. Обе опухоли были признаны злокачественными низкой степени, и пациент получил местное облучение (4000 р). В 1994 году она была госпитализирована в местную больницу с диагнозом ХМЛ o.p. и переведена в гематологическое отделение больницы Ольборга для проверки диагноза и лечения. Исследование аспирата костного мозга и периферической крови подтвердило диагноз ХМЛ. Определение группы крови показало, что пациент O, RhD-отрицательный.Дальнейшее серологическое Rh фенотипирование показало, что эритроциты реагируют следующим образом: C +, c +, E-, e +. Хромосомный анализ был неудачным из-за отсутствия детектируемых метафаз в аспирате костного мозга, стимулированном ФГА. Нормальный кариотип: 46, XX обнаружен в лейкоцитах периферической крови (PBL), но профазы не анализировались. Филадельфийская хромосомная аномалия была первоначально обнаружена в апреле 1994 года с помощью саузерн-блоттинга и была подтверждена в сентябре 1997 года с помощью мультиплексного ПЦР-анализа транскриптов мРНК, который показал наличие транскрипта b3a2 (p210) BCR-ABL, наиболее распространенной хромосомной аномалии, обнаруживаемой у пациентов с ХМЛ. .Лечение ХМЛ было начато в марте 1994 г. с применением 1000 мг / сут гидроксимочевины и продолжено в дозах 1500–2000 мг / сут. Кроме того, пациент получил противоопухолевое лечение ингибиторами эстрогена (тамоксифен, 30 мг / сут). Пациент никогда не получал никаких переливаний. Провести более обширные семейные исследования не удалось: у пациентки нет детей, оба родителя умерли. Один старший брат не хотел жертвовать.
Экспрессия белков из мембранного комплекса Rh на поверхности клетки
Образец эритроцитов пациента был проанализирован с помощью проточной цитометрии с использованием MAb, специфичных для антигенов Rh (D, C, c, E и e) и LW, а также MAb, направленных против Rh50 и CD47 (Таблица II).Антигены C, c и e обычно экспрессировались по сравнению с RhD-положительным (DCCee) и RhD-отрицательным (ddCcee) контролями (таблица II). Не было реактивности ни с анти-E, ни с анти-D антителами, что подтверждает серологические типы, полученные в Ольборге. Антиген D не обнаруживался в тесте на антиглобулин. Однако была обнаружена очень слабая положительная адсорбция-элюция анти-D. Интересно, что количество сайтов антигена LW на красных клетках пациента было ниже, чем на RhD-положительных клетках, и соответствовало количеству, обычно обнаруживаемому на RhD-отрицательных клетках (Таблица II).Rh-родственные белки Rh50 и CD47 присутствовали в аналогичных количествах по сравнению с контролем. Серологическое типирование антигенов других групп крови показало следующий фенотип: MNSs, P1 (+), Lu (a − b +), K − k +, Kp (a − b +), Le (a − b +), Fy (a − b +), Fy (a − b +), K − k +, Kp (a − b +), Le (a − b +), Fy (a + b +), Jk (a + b +), Vel (+), Ge (+). Сила реакций была аналогична клеткам положительного контроля, и никаких реакций смешанного поля не наблюдалось.
Саузерн-блот-анализ генов RH
Полное отсутствие экспрессии антигена RhD в эритроцитах пациента могло быть результатом некоторого изменения гена RHD .Чтобы проверить эту гипотезу, геномную ДНК, выделенную из линии лимфобластоидных клеток EBV, полученной от пациента, расщепляли Hind III и подвергали саузерн-блоттингу с помощью зонда кДНК RhIXb (рис. 1). ДНК от RhD-положительных и RhD-отрицательных доноров включали в качестве контролей. Паттерн гибридизации образца пациента был идентичен таковому для обычных RhD-положительных контролей, о чем свидетельствует наличие полос в 7,5 и 2,7 т.п.н., которые отсутствовали в RhD-отрицательных образцах.Эти данные показывают, что локус RH пациента состоит из двух генов RH , D и CE , в отличие от локуса RhD-отрицательных кавказских людей, который состоит из одного гена CE ( 11).
генов RHD и RHCE соответственно.
Эти результаты также показали, что потеря антигена D не была связана ни с грубой делецией, ни с перестройкой гена RHD .Более того, результаты (рис. 1) показал эффект дозировки гена 1: 2 между некоторыми специфическими рестрикционными фрагментами D и CE ( 10), что указывает на то, что пациент был гетерозиготным (Dd) по гену D, причем одна хромосома несла гены D и CE («гаплотип D»), а другая — только ген CE (‘d гаплотип ‘). Сходные результаты были получены с помощью Саузерн-анализа гидролизатов Bam HI и Eco RI (не показаны).Вероятный генотип пациента — DCe / dce , но это не может быть подтверждено семейными исследованиями (см. Выше).
Анализ транскриптов Rh
РНК ретикулоцитов, выделенной от пациента, подвергали обратной транскрипции, и кДНК D и CE амплифицировали с использованием пар праймеров J-P и J-N, соответственно (Таблица I). Продукты ПЦР ожидаемых размеров (1456 и 1400 п.н. для D и CE соответственно) клонировали в плазмиду PCR TM II и секвенировали.Анализ последовательности транскриптов CE показал присутствие аллелей ce и Ce без изменений. В отличие от этого, делеция одного основания гуанина (G), расположенного в нуклеотиде 600 (далее называемого G600), была обнаружена в кДНК D (фиг. 2). Эта делеция привела к сдвигу рамки считывания после кодона глутамина в положении 200 и привела к преждевременному стоп-кодону в нуклеотиде 682–684 (рис. 2). Предполагаемый размер белка D от пациента при трансляции будет намного короче (227 остатков) по сравнению с нормальным белком D, который включает 417 остатков.
Рис. 2. Анализ последовательности транскриптов RhD от пациента. Нуклеотидная последовательность, окружающая положение 600, и предполагаемая аминокислотная последовательность. Вверху: секвенирование кДНК RhD выявило делецию G (стрелка) в положении 600 у пациента по сравнению с контролем (C). Внизу: делеция нуклеотида G у пациента вызвала сдвиг рамки считывания, что привело к удлинению новой аминокислоты (выделено жирным шрифтом). Звездочка указывает на преждевременный стоп-кодон.
Анализ лимфоцитов и эритробластов
Область, содержащая делецию G600, находится в экзоне 4 гена D . Чтобы подтвердить наличие этой мутации на геномном уровне, мы использовали препарат ДНК из линии лимфобластоидных клеток, трансформированных EBV, полученной от пациента. Фрагмент, окружающий делецию G600, амплифицировали с праймерами P6 (экзон 4) и P7 (экзон 5) ( Таблица I).Амплифицированный фрагмент длиной 728 п.о., охватывающий экзон 4 — экзон 5 гена RHD , был клонирован и секвенирован. Неожиданно не было обнаружено мутации в последовательности экзона 4 гена RHD . Следовательно, эти результаты противоречили друг другу, поскольку делеция G600 присутствовала только в транскриптах D ретикулоцитов, а не в гене D линии лимфоидных клеток. Была повышена возможность соматической мутации в миелоидном компартменте.
Эта проблема была решена путем изучения геномной ДНК из эритроидных клеток, полученных от пациента, в двухфазной жидкой культуральной системе, поддерживающей пролиферацию и дифференцировку эритроидных предшественников, присутствующих в периферической крови (см. Методы).После 8 дней культивирования во второй фазе (Epo-зависимой) популяция клеток, проанализированная на окрашивание GPA и TO, состояла из 12% GPA + TO ++ (эритробласты), 12% GPA + TO + Клетки (ретикулоциты), 1% клеток GPA + TO — (эритроциты) и 75% клеток GPA — (неэритроидные). ДНК и РНК экстрагировали из культивируемых эритробластов (см. «Методы»), а геномный фрагмент, окружающий делецию G600, амплифицировали с парой праймеров P6 – P7 (см. Выше).Был получен продукт ПЦР длиной 728 п.н., вставленный в плазмиду PCR TM II и секвенированный. Делеция G600 присутствовала в трех из четырех проанализированных клонов. Параллельный анализ мРНК (см. Выше) культивированных эритробластов подтвердил наличие делеции G600 в некоторых D-транскриптах.
ПЦР-амплификация с аллель-специфическими праймерами (ПЦР-ASP)
Чтобы определить, была ли делеция G600 специфичной для эритроидного происхождения, была проведена аллель-специфическая ПЦР с использованием D-специфических праймеров P11 и P14 и праймера PIJ, специфичных для мутантного аллеля пациента (см. Таблицу I).ПЦР-амплификации проводили на ДНК-матрицах, экстрагированных из общих лейкоцитов или из очищенного препарата нейтрофилов, а также из культур эритробластов и В-лимфоцитов, трансформированных EBV (рис. 3). Геномную ДНК, выделенную из лейкоцитов периферической крови RhD-положительных и RhD-отрицательных доноров, использовали в качестве контроля. Аллель D дикого типа, амплифицированный с парой праймеров P11 – P14 (773 п.н.), был идентифицирован в D-положительном, но не в D-отрицательном образце, как ожидалось (рис. 3).Полоса из 773 п.н. также присутствовала в крови и В-клетках пациента. В очищенных нейтрофилах был обнаружен только очень слабый продукт амплификации. В культивируемых эритробластах также обнаруживалась полоса 773 п.н., которая предположительно возникла из-за присутствия неэритроидных клеток в препарате (см. Выше) или из некоторых немутантных эритроидных клеток. Это коррелирует со слабой положительной абсорбцией-элюцией анти-D из эритроцитов этого пациента (см. Выше).
Рис 3. Обнаружение мутировавшего аллеля RH с помощью ПЦР-ASP. ПЦР-ASP-амплификация нормального (дикого типа) аллеля RH и мутировавшего аллеля RH (делеция G600) в геномной ДНК от контрольных доноров (C) и пациента. Амплификации с нормальными и мутантными праймерами выполняли на ДНК, выделенной из периферической крови (крови), линии EBV-трансформированных B-лимфобластоидных клеток (B-клетки), культивированных эритробластов (эритроцитов) и нейтрофилов (нейтрофилов), очищенных из периферической крови. Маркер размера (M) представляет собой лестницу 100 п.н.
Мутантный аллель, генерируемый парой праймеров P11 – PIJ, проявлялся в виде сильной полосы в 773 п.н. в образцах лейкоцитов крови, очищенных нейтрофилов и культивированных эритробластов пациента, но не в RhD-положительном и RhD-отрицательном контроле, а также в образцах Образец линии В-клеток от пациента. Этот результат подтверждает, что делеция G600 специфична для миелоидной линии.
ОБСУЖДЕНИЕ
Мы изучали пациентку, у которой резус-фенотип изменился с RhD-положительного на RhD-отрицательный в течение 3-летнего периода (1991–94), в течение которого она проходила лечение мастэктомией (1992) и местным облучением для лечения низкой степени злокачественности. рецидивирующий рак молочной железы, а затем в 1994 году ей был поставлен диагноз ХМЛ, по поводу которого она прошла курс химиотерапии (гидроксимочевина и тамоксифен), но ей так и не сделали переливание крови.
Полная потеря антигена RhD при злокачественных гемопатиях встречается крайне редко, и молекулярная информация об изменениях групп крови у этих пациентов отсутствует. Саузерн-блот-анализ с использованием Rh-специфического зонда показал, что пациент был гетерозиготным по гену RHD и не было грубой реаранжировки локуса RH. Анализ последовательности транскриптов Rh, амплифицированных из ретикулоцитов пациента, выявил делецию одного нуклеотида (G600), локализованную в области, кодируемой экзоном 4 гена RHD , тогда как другие транскрипты были нормальными.Эта мутация привела к сдвигу рамки считывания и привела к преждевременному стоп-кодону в положении 682–684. При трансляции усеченный мутантный белок будет кодировать полипептид из 227 остатков, включая С-конец с 27 новыми остатками. Однако, поскольку D-антиген не обнаруживается на нативных эритроцитах, либо мутантный транскрипт, либо усеченный белок могут разлагаться внутри клеток. Таким образом, отсутствие полипептида RhD на эритроцитах этого пациента привело к «резус-отрицательному» фенотипу, что согласуется с серологическими результатами (см. Выше).Однонуклеотидная делеция в кодирующей области гена RHD является чрезвычайно редким типом мутации, поскольку единственный другой обнаруженный пример относится к семье от пациента с нулевым Rh аморфного типа ( 9). Однако после завершения этого исследования был описан здоровый человек с Rh фенотипом dCCee, несущий интактный ген RHD с изменяющим нонсенс-мутацию кодоном 41 (Gln41 → ter), идентифицированным только путем секвенирования транскриптов Rh ретикулоцитов ( 2).Однако геномный анализ других линий гемопоэтических клеток и членов семьи этого донора не проводился, чтобы определить, была ли мутация унаследована.
Кроме того, мы также продемонстрировали, что делеция G600, присутствующая у нашего пациента, скорее всего, соответствует соматической мутации, поскольку она была обнаружена в эритробластах, выращенных в жидкой культуре, и чистых нейтрофилах из периферической крови, но не в линии B-лимфоидных клеток, полученных из пациент. Эта мутация, скорее всего, произошла в стволовой клетке, общей для всех миелоидных линий.Однако мы не можем исключить, что эта мутация могла произойти в незрелом BFU-E, который имеет низкую способность к самообновлению и все еще может быть до некоторой степени предан другим миелоидным линиям (14, 14; 45). Также возможно, что у нашего пациента с ХМЛ транслокация bcr-abl возникла в клетке, которая уже претерпела эту соматическую мутацию. Расширение таких аномальных клонов) могло бы объяснить распространение мутации в эритроидном компартменте и результирующее изменение фенотипа Rh с D-положительного на D-отрицательный.Дала ли эта мутация некоторое пролиферативное преимущество, или была ли связана с самим лейкемическим процессом, или с лечением, полученным пациентом, в настоящее время неизвестно.
Благодарности
Мы благодарим Джорджио Матасси (INSERM U76, Париж) за критическое прочтение рукописи. Эта работа была частично поддержана фондами Aalborg Frivillige Bloddonorers Fond.
экономических аспектов клонирования и репродукции человека в JSTOR
АбстрактныйХотя большинство дискуссий о клонировании человека начинается и заканчивается этикой, в данной статье анализируется экономика клонирования человека.Я анализирую стимулы к клонированию и его последствия для распределения навыков и доходов в долгосрочной перспективе. Я обсуждаю модели клонирования человека по разным мотивам, сосредотачиваясь на тех, которые имеют тенденцию производить новых людей с улучшенными способностями. Я различаю три случая: клонирование как средство вспомогательной репродукции для бесплодных пар, клонирование фертильными парами с целью получения потомства с высокими способностями и, наконец, клонирование с финансовой мотивацией. Третий случай предполагает, что создатель клона может присвоить некоторую долю будущего дохода клона.Даже если эта доля невелика, возможность производить исключительно талантливых клонов с соответственно высокими доходами может сделать ее прибыльной и, таким образом, превратить клонирование в форму финансовых вложений. Важным следствием этих моделей является то, что в той степени, в которой способность определяется генетически и клонеры предпочитают создавать клоны с высокой способностью, клонирование будет действовать как форма того, что можно было бы назвать «неестественным отбором». Следуя стандартной дарвиновской логике, такой отбор будет иметь тенденцию к увеличению доли людей с высокими способностями в обществе.Действительно, при некоторых предположениях распределение способностей в конечном итоге сходится к точке масс на максимально возможном уровне способностей. При более слабых предположениях показано, что гены, снижающие способность, в конечном итоге устраняются. Эти результаты не зависят от клонирования, вытесняющего половое размножение, или даже от его широкого распространения; они сохраняются, даже если небольшое или даже незначительное количество высококвалифицированных рабочих клонируется в небольшом (но немаловажном) количестве копий. В статье обсуждается правдоподобие моделей и их результаты в свете данных о брачных рынках, отборе детей, воспроизводстве с помощью человека и животноводстве.Наконец, показано, как анализ может быть использован для разработки политики в отношении клонирования, независимо от того, нацелены ли они на его предотвращение или управление его внешними эффектами.
Информация о журналеВ 2005 году экономической политике исполняется 20 лет на переднем крае. дебатов по экономической политике. За два десятилетия с момента создания экономический Политика заработала репутацию во всем мире за публикацию лучших, передовой анализ широкого круга ключевых экономических проблем по мере их появления.Экономическая политика опубликовала некоторые из наиболее цитируемых исследований. в любой точке мира — о финансовых кризисах, дерегулировании, союзах, евро и другие актуальные международные темы. Статьи в «Экономической политике» специально заказываются. от первоклассных экономистов и экспертов в области политики со всего мира Мир. Их задача — осветить актуальные вопросы политики, объединив понимание современной экономики с наилучшими доступными доказательствами. Презентация остроумно и написано простым языком, доступным широкому кругу участников в политических дебатах.
Информация об издателеOxford University Press — это отделение Оксфордского университета. Издание во всем мире способствует достижению цели университета в области исследований, стипендий и образования. OUP — крупнейшая в мире университетская пресса с самым широким присутствием в мире. В настоящее время он издает более 6000 новых публикаций в год, имеет офисы примерно в пятидесяти странах и насчитывает более 5500 сотрудников по всему миру. Он стал известен миллионам людей благодаря разнообразной издательской программе, которая включает научные работы по всем академическим дисциплинам, библии, музыку, школьные и университетские учебники, книги по бизнесу, словари и справочники, а также академические журналы.
Связь между группами крови и болезнями | Кровь
Hirszfeld and Hirszfeld 1 показали, что частота групп крови A и B различается в разных популяциях. Их наблюдения подняли фундаментальные вопросы относительно причин этих различий, которые были красноречиво резюмированы Mourant et al. 2 (p1) :
.Были ли различия результатом случайного генетического дрейфа и эффектов основателя в небольших популяциях, которые позже умножили и стабилизировали исходные, случайные частоты, или они были результатом естественного отбора, возникшего из-за различий в приспособленности между различными группами крови, приспособленностями. которые сами зависели от локально определенных характеристик внешней среды?
Mourant et al. Пришли к выводу, что «большинство рабочих теперь согласны с тем, что оба процесса работают, но их относительная важность остается под вопросом.” 2
Теперь у нас есть подробная информация о почти всех генах, вызывающих полиморфизм групп крови, структуре генных продуктов и самих антигенов, а также во многих случаях функциональной информации, достаточной для описания механизмов взаимодействия с внешними агентами. 3-5 Кроме того, исследования по отслеживанию гаплотипов Y-хромосомы и мтДНК в человеческих популяциях предоставляют нам беспрецедентную информацию о значении генетического дрейфа и эффектов основателя в определении генетического фона различных популяций мира. 6 Учитывая эту новую информацию, кажется подходящим время вернуться к этим вопросам и спросить, приближаемся ли мы к пониманию относительной важности естественного отбора и эффектов основателя в определении распределения групп крови человека.
Молекулярные основы системы групп крови ABO были выяснены в 1990 году. 7 Ген кодирует гликозилтрансферазу, которая переносит N -ацетил-D-галактозамин (группа A) или D-галактозу (группа B) на невосстанавливающие концы. гликанов на гликопротеины и гликолипиды.Фенотип группы O является результатом инактивации гена гликозилтрансферазы A1, и невосстанавливающие концы соответствующих гликанов у субъектов группы O экспрессируют антиген группы крови H (рис. 1A). Антигены ABH не ограничиваются эритроцитами, но широко экспрессируются в жидкостях и тканях организма. Биологическое значение трансферазы A / B не было четко продемонстрировано, но можно было ожидать, что потеря этого функционального белка у пациентов группы O будет иметь некоторые пагубные последствия для пациентов с этой группой крови.
Рисунок 1
Структура ABO, H и антигенов Льюиса . (A) Структура антигенов ABO и H на эритроцитах человека. H-антиген, образованный действием FUT1 на цепи предшественников олигосахаридов, в которых концевой остаток D-галактозы связан с углеродом 4 предпоследнего остатка N -ацетил-D-глюкозамина (цепь типа II). (B) Структура антигенов группы крови Le в выделениях организма.Ген секретора ( FUT2 ) регулирует выработку антигена H, который может быть преобразован в антиген A или B, если присутствует соответствующая активная гликозилтрансфераза ABO. ABH, Le b -активные структуры образуются на цепях предшественников олигосахаридов, в которых концевой остаток D-галактозы связан с атомом углерода 3 предпоследнего остатка N -ацетил-D-глюкозамина (цепь типа I) Если FUT 2 не хватает, Le a активная структура преобладает.
Рисунок 1
Структура ABO, H и антигенов Льюиса . (A) Структура антигенов ABO и H на эритроцитах человека. H-антиген, образованный действием FUT1 на цепи предшественников олигосахаридов, в которых концевой остаток D-галактозы связан с углеродом 4 предпоследнего остатка N -ацетил-D-глюкозамина (цепь типа II). (B) Структура антигенов группы крови Le в выделениях организма. Ген секретора ( FUT2 ) регулирует выработку антигена H, который может быть преобразован в антиген A или B, если присутствует соответствующая активная гликозилтрансфераза ABO.ABH, Le b -активные структуры образуются на цепях предшественников олигосахаридов, в которых концевой остаток D-галактозы связан с атомом углерода 3 предпоследнего остатка N -ацетил-D-глюкозамина (цепь типа I) Если FUT 2 не хватает, Le a активная структура преобладает.
Одной из наиболее значимых ассоциаций заболеваний, описанных для пациентов, не являющихся пациентами группы A, B или AB, и пациентов группы O, является предрасположенность к артериальной и венозной тромбоэмболии (ВТЭ). 8,9 Пациенты, не относящиеся к группе O, имеют больший риск ВТЭ, чем пациенты группы O, и имеют более высокие уровни фактора фон Виллебранда (vWF) и фактора VIII. 8,10 Риск ВТЭ, вероятно, связан с уровнем vWF и фактора VIII, потому что пациенты группы А2 имеют более низкие уровни этих белков, чем А1, В и АВ, и имеют более низкий риск ВТЭ. 9 Антигены групп крови A, B и H экспрессируются на N-гликанах vWF и влияют на период полужизни белка (10 часов для группы O и 25 часов для субъектов, не относящихся к O), обеспечивая объяснение более высокие уровни у пациентов, не страдающих кислородным голоданием. 11 Эти наблюдения повышают вероятность того, что большая склонность к образованию тромбов у пациентов, не относящихся к О, давала преимущество в выживании ранним людям. Такой аргумент был выдвинут в пользу возникновения протромботических мутаций фактора V Лейдена и протромбина 20210G> A, которые обычно обнаруживаются у белых людей и датируются 20 000–24 000 лет назад, ближе к концу последнего ледникового периода. 12 Предполагается, что мутации, подобные фактору V Лейдена, снижают риск кровотечения и / или тяжелых инфекций и, следовательно, риск смерти во время беременности. 13 Подобная гипотеза может объяснить функцию антигенов A и B на vWF.
Что же тогда было стимулом, вызвавшим инактивацию этого гена и создание фенотипа группы O, столь распространенного во всем мире? Недавно были рассмотрены доказательства, подтверждающие мнение о том, что группа крови O обеспечивает избирательное преимущество против тяжелой малярии. 14-16 Аргумент убедительный.Предполагается, что группа O возникла в Африке до миграции первых людей. Тяжелая форма малярии приводит к смерти миллионов людей каждый год до того, как они достигнут детородного возраста, и поэтому отбирает гены выживания. 17 Экспериментальное подтверждение гипотезы предоставлено Fry et al. 18 и Rowe et al. 19 Rowe et al. 19 сообщают об уменьшении розетирования изолятов Plasmodium falciparum из группы O малийских детей по сравнению с группами крови, не являющимися O.Паразитированные эритроциты образуют розетки с неинфицированными эритроцитами и прикрепляются к эндотелию сосудов, вызывая вазокклюзию и тяжелое заболевание.
Существуют и другие примеры инфекционных заболеваний, при которых тяжесть инфекции может быть напрямую связана с фенотипом ABO. Авторы многочисленных исследований показали, что как только человек заражается холерой ( Vibrio cholerae, штаммы O1 El Tor и O139), группа фенотипа O дает большую вероятность тяжелых инфекций, чем фенотипы группы крови, отличной от O. 20 Glass et al. 21 предполагают, что низкая распространенность группы O и высокая распространенность группы B в дельте Ганга в Бангладеш напрямую связаны с избирательным давлением холеры. Почти все недавние пандемии холеры возникли в этом регионе мира. 22 Пациенты группы O были более восприимчивы к вспышке желудочно-кишечных инфекций, вызванной Escherichia coli O157 в Шотландии в 1996 году. 87,5% умерших пациентов были группой O. 23
Однако предположения о том, что оспа производит селекцию против A, что объясняет высокую частоту группы A в Европе и что низкая частота O в древних очагах чумы в Монголии и на Ближнем Востоке также является отражением отбора, не подтверждаются адекватными данными. (Vogel et al [1960], цитируется в Mourant et al 2 (p18) ; Kreiger and Morton 24 ). Более поздние исследования связали высокую частоту мутации устойчивости к ВИЧ-1 CCR5Δ32 в Европе с защитой от оспы и черной смерти. 25 Это предложение также подвергалось сомнению. 26 Мутации A → O и CCRΔ32 произошли намного раньше в эволюции человека, чем эпидемии чумы и оспы в средневековье. Как обсуждалось ранее, мутация A → O, вероятно, была вызвана малярией в Африке до миграции ранних людей в Европу, а CCR Δ32 был описан в скелетах бронзового века. 25 Комбинация отбора против инфекционных заболеваний, таких как чума и оспа, и генетического дрейфа и эффектов основателя в небольших популяциях (в результате моделей миграции ранних людей) может в конечном итоге объяснить частоты аллелей, наблюдаемые сегодня.
Экспрессия антигенов ABH в тканях и жидкостях организма, отличных от клеток крови, регулируется секреторным геном ( FUT2 ), который кодирует альфа 1,2-фукозилтрансферазу, способную переносить L-фукозу на углерод 2 галактозы (бета, 1-3) N -ацетил-D-глюкозамин-содержащие гликаны. В отсутствие активного гена FUT2 (несекретора) созданная структура представляет собой антиген Le a . 27 Продукт гена Le представляет собой альфа-1,3 / 4-фукозилтрансферазу ( FUT3 ), которая переносит L-фукозу на углерод 4 предпоследнего остатка N -ацетил-D-глюкозамина тех же гликанов. 28 Структура, созданная в тканях в результате комбинированного действия FUT2 и FUT3 , представляет собой антиген Le b . Антигены A и B могут образовываться только в тканях пациентов с активным FUT2 под действием альфа-гликозилтрансфераз, способных переносить N -ацетил-D-галактозамин или D-галактозу на углерод 3 тех же гликанов (рис. 1Б).Секреты и ткани человека с активным FUT2 (секретор) могут экспрессировать антигены A, B, H и Le b в этих секретах в соответствии с унаследованными генами гликозилтрансфераз. У европейских и африканских несекреторов часто встречается гомозиготное наследование нонсенс-мутации (G428A), инактивирующей FUT2 , обозначенную se 428 (20% европейцев). 29 В регионах Дальнего Востока и Тихого океана самая распространенная мутация в FUT2 (A385T, se 385 ) вызывает единственное изменение аминокислоты (Ile129Phe) в области ствола фукозилтрансферазы, что приводит к 5-кратному сокращению в активном ферменте и слабом фенотипе Le (a + b +). 30 Секвенирование FUT2 у 732 пациентов из 39 популяций подтвердило широкое распространение аллеля se 428 в Европе, Центральной Азии и Африке и аллеля se 385 на Дальнем Востоке и в Тихоокеанском регионе и нанесено на карту еще 2 аллели с более ограниченным распространением (se 302 и se 571 ) в Центральной и Южной Азии и Камбодже, соответственно. 31 Обладание гомозиготностью по несекреторному фенотипу дает очевидное преимущество в выживаемости при некоторых инфекционных заболеваниях.
Одной из первых доказанных ассоциаций полиморфизма группы крови с заболеванием была связь между группой О и пептической язвой. 32,33 В настоящее время известно, что возбудитель желудочного заболевания H pylori является возбудителем пептической язвы и рака желудка. Согласно Björkholm et al, 34 H. pylori образовал колонии в желудках примерно половины населения мира. 34 Ранние исследования продемонстрировали, что южноамериканский штамм H pylori P466 связан со структурами группы крови O Le b , но не со структурами ALe b на эпителии желудка, что дает четкое объяснение большей восприимчивости группы O секреторы. 35 Более поздние исследования штаммов H pylori из разных частей мира показали, что не все штаммы настолько специфичны для O Le b , причем многие штаммы из-за пределов Южной Америки обладают способностью связываться с ALe b в дополнение к OLe b .Тем не менее, эти штаммы обладают большей аффинностью связывания с OLe b по сравнению с ALe b (примерно в 5 раз [медиана] выше). 36 Анализ последовательности бактериальной поверхностной молекулы, ответственной за связывание с эпителием желудка BabA (антигенсвязывающий адгезин группы крови) из различных штаммов H pylori , показал, что перуанские штаммы были тесно связаны с испанскими, но не с азиатскими штаммами, что поднимает интригующий вопрос. возможность того, что штаммы, специфичные для OLe b , обнаруженные в Южной Америке, возможно, возникли после европейской колонизации Южной Америки в 16 веке и представляют собой адаптацию к популяции, которая почти полностью принадлежит фенотипу группы крови O. 36
Восприимчивость к норовирусной инфекции также тесно связана с экспрессией антигенов ABH и Le в желудочно-кишечном тракте. Норовирусы являются наиболее частой причиной острого гастроэнтерита у людей и, по оценкам, составляют от 60% до 85% всех вспышек гастроэнтерита в развивающихся странах. 37 Они передаются при употреблении зараженной пищи, особенно устриц, которые могут концентрировать вирус, или при контакте с зараженной водой. 37 Ключевая роль секреторного статуса в определении восприимчивости к норовирусу была четко продемонстрирована Thorven et al, 38 , которые сравнили восприимчивость к гастроэнтериту у пациентов и медицинского персонала, участвовавших в вспышках заболеваний в больницах в Швеции. Результаты показали, что только пациенты, гомозиготные по несекретору, были защищены от инфекции. Ларссон и др. 39 также продемонстрировали значительно более низкие титры антител к норовирусу GGII у несекреторов по сравнению с секреторами.Однако существует множество различных штаммов норовируса, и некоторые из них связываются с несекреторными структурами Le a и вызывают симптоматическую инфекцию. 40,41 Переменная специфичность различных штаммов к структурам ABH и Le b , о которых сообщается, отражает такое же разнообразие, как и у вышеупомянутого H pylori . Также были представлены доказательства большей восприимчивости секреторов к вирусам гриппа, риновирусам, респираторно-синцитиальному вирусу и эховирусам. 42 Сниженный риск заражения ВИЧ-инфекцией 1 типа был обнаружен у сенегальских работников коммерческого секса с несекреторским типом. 43 О медленном прогрессировании ВИЧ-1 у несекреторов также сообщили Kindberg et al. 44
Несекреторы более восприимчивы к инфекциям, вызываемым Haemophilus influenzae , 45 Neisseria meningitidis и Streptococcus pneumoniae 46 и инфекциям мочевыводящих путей, вызванным E. coli . 47
Мутация (ΔF508) в гене трансмембранного регулятора муковисцидоза ( CFTR ) часто встречается у европейских пациентов и присутствовала в Европе в период палеолита более 10 000 лет назад. 48 Возможность того, что различия в экспрессии антигенов A, B и H в слизи дыхательных путей могут приводить к различиям в связывании микробов и предрасполагать к более тяжелым заболеваниям легких, была исследована на 808 пациентах, гомозиготных по ΔF508.Связи с генотипом ABO, Se или Le не наблюдалось. 49
Основным клиническим заболеванием, связанным с системой группы крови Rh, является гемолитическая болезнь плода и новорожденного (HDFN). HDFN обычно возникает, когда мать с группой крови D- вынашивает плод с группой крови D +, а эритроциты плода, попадающие в кровоток матери, иммунизируют мать, вырабатывая антитела к D, которые проходят через плаценту и повреждают плод.До внедрения успешного профилактического лечения в 1968 году частота заболевания в Англии и Северной Америке составляла примерно 1 на 170 рождений. 3 Распознавание болезни как единого целого происходило медленно. В тяжелых случаях анти-D проникает через плаценту и вызывает внутриутробную гибель плода — состояние, известное как водянка плода. Чаще заболевание возникает в неонатальном периоде, когда тяжелая и острая анемия и тяжелая желтуха приводят к летальному исходу — заболеванию, известному как желтуха новорожденного.Робертс 50 цитирует рассказ Луизы Буржуа, акушерки Марии Медичи, которая опубликовала в 1609 году, вероятно, самое раннее сообщение о водянке плода у одного близнеца и желтухе новорожденного у другого, и приписывает Одену (1905) несколько ключевых наблюдений. относящиеся к неонатальной желтухе, в частности ее появлению у следующих друг за другом детей одних и тех же родителей. Признание того, что водянка плода и желтуха новорожденных являются проявлениями одного и того же заболевания, постепенно появилось в течение 1920-х годов, а в 1939 году было показано, что анти-D является его возбудителем. 51
В настоящее время существует огромное количество доказательств, подтверждающих гипотезу о том, что люди произошли в Африке, и для определения временных рамок различных миграций из Африки, которые привели к появлению нынешних популяций мира. 6 Просто наложив известное распределение частот групп крови на карту мира миграций людей, становится очевидным потенциальное значение дрейфа генов и эффектов основателя.Wells 6 утверждает, например, что можно учесть все типы мтДНК и Y-хромосомы у коренных американцев с населением от 10 до 20 человек. Неудивительно, что коренные американцы почти исключительно принадлежат к группе крови O 52 или что полиморфизм группы крови Di a отслеживает миграцию людей из Восточной Азии в Америку. 52 Появление антигена Di a в юго-восточной Польше также дает представление о степени проникновения монгольских нашествий в Европу в последнее время. 53,54
В Европе подобный эффект основателя может быть использован для объяснения высокой частоты фенотипа D-. Появление палеолитических предков, переживших последний ледниковый период из убежищ в баскском регионе Северной Испании и Южной Франции и Украины от 10 000 до 15 000 лет назад, и последующее скрещивание этих выживших с неолитическими мигрантами с Ближнего Востока дает объяснение возникновение HDFN.Чтобы объяснить высокую частоту аллеля D- в Европе, Mourant 55 предложил смешать 2 популяции, одна в основном D-, а другая D +. Он отметил, что частота D- была очень высокой у басков, и постулировал причину смешения палеолитических народов из баскского региона с неолитическими мигрантами. В последующие годы эта гипотеза в значительной степени игнорировалась, но недавние наблюдения, сделанные с использованием мтДНК и маркеров Y-хромосомы, привели к широкому признанию гипотезы смешения популяций (рис. 2). 52,56-58
Рисунок 2
Палеолитические поселенцы из последнего ледникового максимума могут быть источником высокой частоты аллеля D- у европейцев . (Вверху) Европейское расположение палеолитических рефугий во время последнего ледникового максимума. Обратите внимание на миграцию популяции, содержащей маркер M173 (из Gibbons 58 ; перепечатано с разрешения Американской ассоциации содействия развитию науки).(Внизу) Распространение аллеля D- в Европе (из Mourant et al. 52 ; перепечатано с разрешения Oxford University Press).
Рисунок 2
Палеолитические поселенцы из последнего ледникового максимума могут быть источником высокой частоты аллеля D- у европейцев . (Вверху) Европейское расположение палеолитических рефугий во время последнего ледникового максимума. Обратите внимание на миграцию популяции, содержащей маркер M173 (из Gibbons 58 ; перепечатано с разрешения Американской ассоциации содействия развитию науки).(Внизу) Распространение аллеля D- в Европе (из Mourant et al. 52 ; перепечатано с разрешения Oxford University Press).
Отслеживание гаплотипов, происходящих из баскских и украинских убежищ, показало, что эти популяции мигрировали по Европе и Центральной Азии, а также в Индию и Пакистан. 59 HDFN находится во всех этих регионах. Mourant 55 также предположил связь между басками и берберами Северной Африки из-за высокой частоты фенотипов D- среди берберов.Эта гипотеза теперь подтверждается данными с помощью маркеров материнской ДНК, показывающими, что предки берберов заняли территорию баскского убежища и мигрировали обратно в Северную Африку. 60 В Западной Европе фенотип D- является результатом полной делеции RHD . 61 Молекулярная основа фенотипа D- у украинских D- формально не определена. Потеря белка RhD, по-видимому, не оказывает значительного ущерба для функции эритроцитов. Наилучшие доступные структурные модели для белка RhD и его гомолога белка RhCE показывают, что они не функционируют как транспортные белки, а скорее служат для облегчения сборки газотранспортного комплекса белка полосы 3 в мембране эритроцитов.Эти наблюдения показывают, что существует значительная функциональная избыточность, при которой белки D и CE эффективно замещают друг друга (рис. 3). 62
Рисунок 3
Структура мембраны эритроцитов человека, показывающая основные поверхностные белки и минорные белки Fy и CR1 . Изображены два основных мембранных комплекса, связанных с нижележащим скелетом эритроцитов. Комплекс Band 3, содержащий гликофорины A (GPA) и B (GPB) и Rh-белки, Rh-ассоциированный белок (RhAG), CD47, гликопротеин LW (молекула межклеточной адгезии –4), и соединительный комплекс, содержащий гликофорины C и D (GPC , GPD), гликопротеин Kell, гликопротеин XK и гликопротеин Даффи (Fy).Также показаны аквапорин 1 (AQP1), переносчик глюкозы (GLUT1), фактор ускорения распада (DAF, CD55) и рецептор комплемента 1 (CR1). Активные олигосахариды ABH, которые, как известно, присутствуют на всех основных поверхностных белках, за исключением белков Rh, не показаны.
Рисунок 3
Структура мембраны эритроцитов человека, показывающая основные поверхностные белки и минорные белки Fy и CR1 . Изображены два основных мембранных комплекса, связанных с нижележащим скелетом эритроцитов. Комплекс Band 3, содержащий гликофорины A (GPA) и B (GPB) и Rh-белки, Rh-ассоциированный белок (RhAG), CD47, гликопротеин LW (молекула межклеточной адгезии –4), и соединительный комплекс, содержащий гликофорины C и D (GPC , GPD), гликопротеин Kell, гликопротеин XK и гликопротеин Даффи (Fy).Также показаны аквапорин 1 (AQP1), переносчик глюкозы (GLUT1), фактор ускорения распада (DAF, CD55) и рецептор комплемента 1 (CR1). Активные олигосахариды ABH, которые, как известно, присутствуют на всех основных поверхностных белках, за исключением белков Rh, не показаны.
Контраргумент гипотезе смешивания популяций будет обеспечен четкой демонстрацией отбора по фенотипу D- факторами окружающей среды.При тщательном обзоре ранних исследований, направленных на выявление ассоциаций между полиморфизмом D и заболеваниями, Mourant et al. 2 не выявили убедительных ассоциаций. Совсем недавно в двух исследованиях сообщалось о связи полиморфизма D с заболеванием. Бускетс и др., 63 в исследовании из Барселоны, сообщили о повышенной частоте желчных осложнений у реципиентов трансплантата печени, несоответствующей D. Наличие желчных осложнений в D-неидентичных случаях трансплантат-хозяин (23 [30%] из 76 ) было больше, чем в D-идентичных трансплантатах (47 [17%] из 269).Полипептиды Rh не экспрессируются в печени, 64 , и поэтому механизм такой ассоциации не ясен. Тот факт, что исследование проводилось в баскском регионе Испании, где фенотип D- очень распространен и может быть результатом древних поселений палеолита, может иметь большое значение для интерпретации этих результатов, поскольку он повышает вероятность того, что другие гены более релевантны. на трансплантацию, а также чаще встречается у басков, чем у других популяций, может повлиять на результаты.В этом контексте интересно отметить доказательства того, что генотип донорского лейкоцитарного антигена С человека (HLA-C) оказывает сильное влияние на исход трансплантации печени. 65 HLA-C является основным ингибирующим лигандом для иммуноглобулин-подобных рецепторов (KIR) клеток-киллеров. Гены KIR очень полиморфны и экспрессируются на естественных клетках-киллерах и на подмножестве Т-лимфоцитов. 66,67 Несколько генов KIR ( KIR2DS5 , KIR3DS1 , KIR2DL2 ) значительно различаются по частоте у басков, и Santin et al. Идентифицировали 3 новых гаплотипа. 68
Flegr et al. 69 в исследовании из Чешской Республики сообщают об ассоциации полиморфизма с инфекцией Toxoplasma gondii , при этом субъекты (призывники) с фенотипом D-, инфицированные T gondii (11 [6,08% ] из 181) имели более медленное время реакции и, следовательно, были вовлечены в большее количество дорожно-транспортных происшествий, чем пациенты D +, инфицированные T gondii (17 [2.4%] из 709). Белок Rh D не экспрессируется в головном мозге; следовательно, вероятный механизм такой ассоциации неясен, и, учитывая небольшое количество инфицированных T gondii пациентов, участвовавших в исследовании, потребуется гораздо более крупное когортное исследование, чтобы доказать достоверность этой связи.
Учитывая имеющиеся на сегодняшний день данные, представляется наиболее вероятным, что частота D + и D- негативных фенотипов в Европе и Центральной Азии является отражением генетического дрейфа и миграции, а не естественного отбора, поскольку первые колонисты Европы вышли из Африки с удаление RHD (рисунок 2).Остается возможность, что первоначальный стимул, приводящий к этой делеции, произошел в Африке в результате отбора. Сопутствующее возникновение фенотипа D- в африканских популяциях в результате другого молекулярного механизма 70,71 может указывать на некое древнее давление отбора.
Представляется вероятным, что наиболее разрушительные последствия малярии для человеческих популяций совпали с изменением образа жизни от охотников-собирателей к более оседлым методам ведения сельского хозяйства около 10 000 лет назад. 15 Вырубка деревьев из лесных массивов создала потенциал для луж со стоячей водой и нерестилищ для комаров-переносчиков паразитов.
Ярчайшие примеры отбора перед лицом малярии отражаются в широком распространении наследственных анемий, особенно серповидно-клеточной анемии и альфа-талассемии, а также в появлении гемоглобина C в регионах мира, где малярия является эндемичной. 72,73 Мутация, приводящая к серповидно-клеточной анемии (SCD; HbS), могла возникнуть в 3 разных местах в Африке (Атлантический, Западная Африка, Центральная Западная Африка и говорящие на банту Центральная и Южная Африка) с расширением мутации. произошедшие от 2000 до 2500 лет назад. 74 В этом случае пациенты, которые наследуют ген HbS от обоих родителей, имеют SCD, тогда как пациенты, которые являются гетерозиготными, наследуя ген HbS от одного родителя и нормальный ген HbA от другого родителя, имеют существенную защиту от малярии.Подобный защитный эффект для гетерозиготы представляется вероятным в Юго-Восточной Азии, где HbE очень распространен, а эритроциты пациентов с генотипом HbAE заметно менее восприимчивы к инвазии малярийных паразитов in vitro. 75
Дальнейшими иллюстрациями разнообразия мутаций, возникших в ответ на малярию, являются дефицит глюкозо-6 фосфатдегидрогеназы, широко распространенный в Средиземноморье и Индии, 72 и полиморфизм в промоторе индуцибельной синтазы оксида азота. 76
Полное отсутствие в эритроцитах молекулы, несущей антигены группы крови Даффи (также известного как DARC), обнаруживается почти у 100% жителей Западной Африки, и это отсутствие ясно и недвусмысленно продемонстрировано для обеспечения защиты от P vivax . 77 Молекулярная основа этого дефицита Даффи — точечная мутация в сайте связывания фактора транскрипции GATA-1. 78 GATA-1 представляет собой ДНК-связывающий белок, необходимый для эритропоэза, и его неспособность связываться с промотором гена Даффи означает, что белок Даффи отсутствует в эритроцитах пораженных субъектов. У африканцев мутация происходит на аллеле Даффи, который в противном случае генерировал бы фенотип Fy (b +). Та же самая мутация GATA-1, по-видимому, произошла во второй раз в Юго-Восточной Азии, где она встречается на аллеле Даффи, который в противном случае генерировал бы фенотип Fy (a +). 79 Другая мутация, вызывающая слабую экспрессию Даффи (Fy x ), также может иметь отношение к малярии, но о соответствующих популяционных исследованиях не сообщалось. 80 Недавно в Южной Америке и Восточной Африке появились доказательства появления штаммов P vivax , способных проникать в эритроциты Fy (a − b−). 81,82
Защитный эффект фенотипа Fy (a-b-) против P vivax ясен и однозначно установлен. Не столь ясны какие-либо пагубные последствия этой мутации для субъектов, выражающих фенотип.Белок Даффи экспрессируется на эндотелиальных клетках у этих субъектов, но не на эритроцитах, 83 , поэтому любая попытка понять последствия дефицита Даффи красных клеток должна учитывать функциональную роль эндотелиального Даффи. Белок Даффи является членом семейства 7 хемокиновых рецепторов, охватывающих мембраны (рис. 3), но в отличие от большинства хемокиновых рецепторов не влияет на внутриклеточную передачу сигналов через G-белки. Он связывает несколько провоспалительных хемокинов как подсемейств CXC, так и CC, но не связывает гомеостатические хемокины. 84 Последние данные свидетельствуют о том, что белок Даффи на эндотелиальных клетках связывает хемокины и способствует экстравазации лейкоцитов, способствуя патогенезу заболевания через воспаление. 85 Доказательства повышения экспрессии Даффи в эндотелии сосудов во время инфекции и отторжения трансплантата подтверждают эту точку зрения. 86,87
Отсутствие Даффи в эритроцитах у пациентов с Fy (a-b-) изменяет баланс провоспалительных хемокинов в организме, поскольку отсутствует очень большая способность связываться с эритроцитами, но последствия этого изменения в настоящее время неясны.Lee et al., , 88, предоставляют доказательства того, что эритроциты и эндотелиальные клетки Даффи регулируют кинетику биодоступности хемокинов между кровообращением и внесосудистыми участками во время воспаления. Ясно, что это регулирование будет изменено у субъектов Fy (a − b−). В модели на мышах воспаление, вызванное полицитидиловой кислотой, значительно усилило аллоиммунизацию к эритроцитам. 89 В этом контексте интересно отметить, что пациенты с SCD преимущественно относятся к фенотипу Fy (a − b−) и что продукция множественных аллоантител к эритроцитам при переливании (обычно с кровью от белых доноров) является частой и значительная проблема, с которой сталкиваются сотрудники банков крови, стремящиеся предоставить пациентам совместимую кровь (см. Anstee 90 ).Пациенты с ВСС в период серповидноклеточного кризиса и мышиные модели ВСС у человека имеют много индикаторов воспалительной реакции. 91 Эти данные предполагают, что повышенная склонность к аллоиммунизации у пациентов с SCD связана с воспалением, а также ставят вопрос о значении Fy (a-b-) в этом процессе. Являются ли пациенты с Fy (a-b-) SCD с большей вероятностью вырабатывать аллоантитела в ответ на переливание крови, чем пациенты с SCD с нормальным фенотипом Fy? Есть ли связь между регуляцией доступности провоспалительных хемокинов Fy эритроцитов и адаптивным иммунным ответом?
Данные Afenyi-Annan et al. 92 предоставляют доказательства того, что пациенты с SCD с фенотипом Fy (a-b-) более восприимчивы к хроническому повреждению органов и протеинурии, чем пациенты с SCD с нормальным фенотипом Fy, и согласуются с такой гипотезой. .На интерпретацию, вероятно, также влияют генетические различия иммунного ответа и генов цитокинов в африканских популяциях по сравнению с другими мировыми популяциями, 93,94 , но генетический фон пациентов с SCD с нормальным фенотипом и фенотипом Fy (a − b−) может быть достаточно сопоставимым. чтобы сделать выводы относительно аллоиммунизации и роли Fy. Если субъекты Fy (a-b-) будут более восприимчивы к аллоиммунизации, то потенциальное использование противовоспалительной терапии при лечении вазоокклюзии 95,96 может иметь дополнительный бонус в виде снижения скорости аллоиммунизации эритроцитов и обеспечения столь необходимый альтернативный подход к серьезной проблеме переливания крови.
Еще одним следствием отбора по фенотипу Fy (a-b-) в Африке может быть изменение кинетики инфекции ВИЧ-1 у людей с этим фенотипом. Несколько штаммов ВИЧ-1 связываются с Даффи на нормальных эритроцитах, облегчая перенос ВИЧ-1 к его клеткам-мишеням (CD4 + / CCR5 + Т-лимфоциты) с 5-12-кратной эффективностью, чем Fy (a −b−) эритроциты. 97 He et al. 97 подсчитали, что пациенты с фенотипом Fy (a − b−) имеют на 40% большую вероятность заражения ВИЧ, чем пациенты без фенотипа; однако однажды приобретенное заболевание прогрессирует медленнее, чем у инфицированных пациентов с нормальным типом Fy.Они пришли к выводу, что эти различия связаны с потерей конкуренции за связывание ВИЧ-1 между плазменным хемокином CCR5 и Duffy на эритроцитах у Fy (a-b-) субъектов и с последующими изменениями воспалительного состояния у инфицированных. Результаты этого исследования были опровергнуты Walley et al, 98 , которые использовали другую методологию для анализа другой когорты ВИЧ + и ВИЧ- афроамериканцев и не обнаружили связи между генотипом Fy и прогрессированием до СПИДа или риском заражения ВИЧ.Они также указывают на то, что количество патентов на ВИЧ, использованных Валли и др. 98 , было намного меньше (227 против 814), и предполагают, что это различие может быть основным фактором, влияющим на анализ. 99
Двойная доступность систем культивирования in vitro для изучения вторжения в эритроциты человека P falciparum и хорошо охарактеризованных фенотипов редких групп крови позволила идентифицировать рецепторы эритроцитов, используемые различными штаммами паразитов.Ранние исследования клеток, лишенных гликофорина A (Ena- клетки 100 ) и гликофорина B (S-s- клетки 101 ), предоставили доказательства того, что эти богатые сиаловой кислотой поверхностные гликопротеины эритроцитов были паразитарными рецепторами, и эти наблюдения были подтверждены. 102-105 Гликофорины C (GPC) и D (эритроциты Ge) также являются рецепторами для некоторых штаммов P falciparum . 106-108 Гликофорины являются основными белками на поверхности эритроцитов (рис. 3). Гликофорин A (GPA) и основной транспортный белок анионов (AE1, Band 3) с примерно 10 6 копий на эритроцит являются наиболее распространенными поверхностными белками эритроцитов с гликофоринами B, C и D, вместе составляющими еще 450000 копий на красную клетку. 109,110
Возможно, что удивительно, существует мало экспериментальных доказательств того, что отбор против экспрессии GPA произошел в ответ на инфекцию P falciparum . Сообщается, что эритроциты пациентов, имеющих гибридный белок GPA-GPB Dantu, который является обычным в некоторых частях Африки, противостоят инвазии, 111 , и было высказано предположение, что повышенная экспрессия Band 3 наблюдается у пациентов с GPB-GPA -GPB MiIII-белок, распространенный в Юго-Восточной Азии, может иметь значение для выживания при малярии. 112 Значение сиаловой кислоты для GPA в формировании рецептора для P falciparum 102 предполагает, что эритроциты, экспрессирующие варианты гликозилирования GPA, обычно встречающиеся у африканцев, в которых N -ацетил-D-глюкозамин присутствует в некоторых из богатые сиаловой кислотой O-гликаны на N-конце (пациенты с антигеном M 1 113 ) могут иметь отношение к предрасположенности к малярии.
В отличие от ситуации с GPA, субъекты с недостатком гликофорина B часто встречаются в Центральной Африке. 105 Пациенты с эритроцитами без GPC и гликофорина D (Ge-, фенотип выщелачивания) очень редки, но пациенты с эритроцитами Ge-, имеющими измененный GPC в результате делеции экзона 3 из GYPC 114,115 , часто встречаются в Меланезийцы, особенно в Папуа-Новой Гвинее, и полученный фенотип обеспечивает защиту от P falciparum (рис. 4). 72,108 Очевидно, что различные штаммы P falciparum нацелены на гликофорины, связанные с одним или другим мембранным комплексом, обеспечивая ключевые цитоскелетные связи, поддерживающие стабильность мембраны эритроцитов (рис. 3) и селекцию, что приводит к потере или изменению гликофоринов. в любом из этих сайтов дает преимущество в выживании.
Рисунок 4
Распределение фенотипов редких групп крови, выбранных малярией, в Африке и Юго-Восточной Азии . Расположение фенотипов редких групп крови, лишенных гликофорина B (Ss-), имеющих измененный гликофорин C (Ge-; Gerbich-негативный), Fy (Duffy) — нулевой аллель (Fy) группы крови, аллель Sl (a-) рецептора комплемента 1 (CR1) и мутации Band 3, вызывающей овалоцитоз в Юго-Восточной Азии (SAO), по сравнению с распределением аллелей HbS и HbE. 72
Рисунок 4
Распределение фенотипов редких групп крови, выбранных малярией, в Африке и Юго-Восточной Азии . Расположение фенотипов редких групп крови, лишенных гликофорина B (Ss-), имеющих измененный гликофорин C (Ge-; Gerbich-негативный), Fy (Duffy) — нулевой аллель (Fy) группы крови, аллель Sl (a-) рецептора комплемента 1 (CR1) и мутации Band 3, вызывающей овалоцитоз в Юго-Восточной Азии (SAO), по сравнению с распределением аллелей HbS и HbE. 72
Меланезийцы также демонстрируют другой пример отбора, обеспечивающий защиту от церебральной малярии, фенотипа, известного как овалоцитоз Юго-Восточной Азии. Клетки овалоцитоза Юго-Восточной Азии, как следует из названия, имеют аномальную форму. Они также характеризуются ослабленной экспрессией большого количества антигенов группы крови, включая антигены, обнаруженные на Band 3, GPA и белки группы крови Rh. 116 В этом случае отбор благоприятствует гетерозиготе. Гетерозиготы наследуют нормальный ген Band 3 вместе с мутантным неактивным геном Band 3 в результате делеции, вызывающей потерю 9 аминокислот в точке, в которой цитоплазматический N-концевой домен входит в цитозольную поверхность липидного бислоя (обзор у Брюса 117 ). Гомозиготное наследование этой мутации привело бы к полному дефициту Band 3. Поскольку полоса 3 важна для дыхания (обмен Cl / HCO 3 ) и для поддержания целостности мембраны эритроцитов, с точки зрения эволюции следует предположить, что такое наследование несовместимо с выживанием.Описаны редкие пациенты с общим дефицитом Band 3, но выживаемость зависит от обширной медицинской поддержки, особенно в неонатальном периоде. 118
Рецептор комплемента 1 (CR1; рис. 3) несет антигены системы группы крови Knops. Экспрессия CR1 очень варьирует между пациентами, и эритроциты, экспрессирующие менее 100 копий CR1 на клетку, демонстрируют пониженное розетение при штамме R29R P falciparum , как и красные клетки, экспрессирующие фенотип группы крови Sl a -.Фенотип Sl a -, который является результатом однонуклеотидного полиморфизма (R1601G) в длинном гомологичном повторе D, встречается только у 1% белого населения, но достигает 70% у малийцев. 119-121
Значение групп крови человека теперь можно более четко увидеть в контексте движения населения и постоянной борьбы между людьми и инфекционными заболеваниями. Доказательства отбора по инфекционным заболеваниям на уровне генов ABO и секреторных генов убедительны, но для других антигенов группы крови эффекты основателя с большей вероятностью объясняют распределение полиморфизмов групп крови, за исключением тех частей мира, в которых малярия эндемичен.Имеющиеся данные свидетельствуют о том, что выживаемость от малярии является наиболее значимой силой отбора, действующей на группы крови.
Фенотипы редких групп крови, выявленные в результате испытаний на совместимость в центрах переливания крови и банках крови по всему миру, предоставили мощные инструменты для исследования механизмов, посредством которых малярийные паразиты проникают в эритроциты человека. Однако всестороннее исследование распределения известных полиморфизмов групп крови в районах, эндемичных по малярии, не проводилось.Теперь, когда клонированы почти все гены групп крови и определены молекулярные основы большинства антигенов, можно провести такое исследование с использованием высокопроизводительных методов на основе ДНК. 122-125 Более того, доступность методологий быстрого секвенирования ДНК предвещает эпоху, когда массовый скрининг генов, кодирующих белки мембран красных клеток, может быть использован для выявления новых полиморфизмов, имеющих отношение к малярийной инвазии. Исследования этого типа, сосредоточенные в тропической Африке, Юго-Восточной Азии и Латинской Америке, предоставят ценную базу данных новой информации о разнообразии групп крови в популяциях, населяющих эти регионы, не только для малярийных эпидемиологов, но и для тех, кто изучает восприимчивость людей к новым возникающим заболеваниям. инфекционные заболевания, учитывая, что зоонозы диких животных в этих регионах были определены как наиболее значительная растущая угроза глобальному здоровью среди всех возникающих инфекционных заболеваний. 126
% PDF-1.6 % 91 0 объект > эндобдж xref 91 82 0000000016 00000 н. 0000002864 00000 н. 0000003047 00000 н. 0000003107 00000 н. 0000003149 00000 п. 0000003420 00000 н. 0000003830 00000 н. 0000004195 00000 н. 0000004831 00000 н. 0000004878 00000 н. 0000005309 00000 н. 0000005387 00000 п. 0000005455 00000 н. 0000005777 00000 н. 0000005825 00000 н. 0000005899 00000 н. 0000005947 00000 н. 0000006022 00000 н. 0000006077 00000 н. 0000012372 00000 п. 0000012665 00000 п. 0000013042 00000 п. 0000013118 00000 п. 0000013624 00000 п. 0000014017 00000 п. 0000014188 00000 п. 0000014919 00000 п. 0000015332 00000 п. 0000015655 00000 п. 0000016173 00000 п. 0000016452 00000 п. 0000017200 00000 н. 0000017495 00000 п. 0000017780 00000 п. 0000018377 00000 п. 0000018636 00000 п. 0000018745 00000 п. 0000019059 00000 п. 0000019463 00000 п. 0000020192 00000 п. 0000020829 00000 п. 0000021097 00000 п. yȒR3hG] Q99 / tHΉ & V’GkWPfi4 «/ ӄpL $»] / շ # Cx
Почему ученые еще не клонировали людей?
- Технически мы можем клонировать людей почти десять лет.
- Итак, почему мы этого не сделали? Ответ больше связан с наукой, чем с моралью.
- Клонирование не только неэффективно и опасно, но еще и недостаточно веских причин, чтобы сделать человека таким.
- Но создание полных копий людей — не единственный способ потенциально использовать клонирование на благо людей.
Ниже приводится стенограмма видео.
Рассказчик: Мы можем клонировать человеческие эмбрионы около семи лет.Но, насколько нам известно, на самом деле никто не клонировал целого человека. Оказывается, ученых сдерживает не только этика. Мы думаем, что клонирование — это не чудо научной фантастики. Это может быть опасно, часто неэффективно, и, самое главное, мы просто не придумали достаточно веской причины для этого. Итак, вот почему вам, вероятно, никогда не придется сражаться со своим злым клоном.
Это Долли. Шучу, это обычная овца. Это Долли, первое млекопитающее, успешно клонированное из взрослой клетки. Она родилась в 1996 году после того, как ученые выяснили, как удалить ДНК из яйцеклетки шотландской овцы Blackface и фактически заменить ее ДНК клетки молочной железы овцы Финн-Дорсет.Они слегка ударили током, чтобы слились клетки и заставить их размножаться, поместили клетки в матку другой овцы и бум, клон. Этот метод, называемый репродуктивным клонированием, теоретически может быть использован на людях. Но это в лучшем случае. Ученым потребовалось 277 попыток, чтобы заполучить одну Долли. В настоящее время успешность клонирования млекопитающих составляет от 10% до 20%. Лучше, чем один из 277, но все же в значительной степени неэффективный процесс.
Jose Cibelli: Технически получить клонированный эмбрион несложно, но клонирование человека имеет другие препятствия, которые необходимо учитывать.
Рассказчик: Чтобы даже исследовать клонирование человека, ученым необходимо с этической точки зрения собрать большое количество пожертвованных яйцеклеток и найти достаточно суррогатов, чтобы их нести. Но даже если они пройдут через этот логистический кошмар, самая большая проблема заключается в следующем:
Cibelli: Они причинят вред ребенку или причинят вред человеку, несущему клонированный плод.
Рассказчик: Ученые обнаружили, что некоторые эмбрионы умирают до того, как имплантируются.Другие приводят к выкидышам. А те, кто доживает до срока, часто умирают вскоре после рождения или в конечном итоге получают серьезные отклонения от нормы. Попросту говоря, это риски, которые легче принять, когда дело доходит до экспериментов с овцами, чем с людьми. Но, возможно, самая большая причина, по которой мы не клонировали человека? Для этого нет достаточно веских причин.
В поп-культуре клонирование используется для воскрешения людей из мертвых. Но это не так. Клонирование кого-либо приведет к созданию только близнеца, а не копии, поскольку однояйцевые близнецы имеют одинаковую генетику, но не обязательно личности.А сценарий «Never Let Me Go», в котором органы извлекают у клонов для спасения богатых, не только неэтичен, но и ненужен. Зачем клонировать человека целиком, если можно сделать только ту часть, которая вам нужна? Что-то, теоретически, может решить терапевтическое клонирование.
Терапевтическое клонирование почти идентично репродуктивному, за исключением того, что клонированный эмбрион никогда не имплантируется в матку. Вместо этого эмбрион клонируется с единственной целью — извлечь стволовые клетки. Стволовые клетки обладают невероятной способностью превращаться в любую другую клетку человеческого тела, а это означает, что они отлично подходят для разработки новых методов лечения болезней и обладают потенциалом для восстановления или регенерации тканей и органов.
Но неудивительно, что терапевтическое клонирование имеет ряд недостатков. Дело в том, что стволовые клетки — довольно ограниченный ресурс. Самый важный источник эмбриональных стволовых клеток? Эмбрионы возрастом от трех до пяти дней, клонированные или другие. А когда пациенту пересаживают чужие стволовые клетки, организм иногда борется с ними, как с болезнью. Некоторые исследователи полагают, что клонированные стволовые клетки, поскольку они имеют общую ДНК пациента, с меньшей вероятностью будут отвергнуты.Но этот вариант использования все еще находится на стадии исследования.
И, наконец, терапевтическое клонирование — это индивидуализированное лечение в мире, где фармацевтические компании больше заинтересованы в стандартизированных методах лечения. В настоящее время есть более простые способы создания многоцелевых клеток, например, метод создания индуцированных плюрипотентных стволовых клеток. По сути, это взрослые клетки, перепрограммированные в клетки другого типа.
Cibelli: Проблема терапевтического клонирования, конечно же, заключается в том, что вам нужен квалифицированный персонал лаборатории, чтобы это делать, и специальное оборудование.В то время как другой метод, вы можете просто купить набор, и один человек может сделать это в лаборатории, имеющей некоторый опыт в культуре тканей.
Рассказчик: Клонированные клетки по-прежнему имеют преимущество, когда речь идет о более здоровых митохондриях и способности расти в целых животных, тогда как ИПСК часто иссякают. Но поскольку ИПСК безопасно и надежно делают почти все, кроме создания целых живых животных, зачем финансировать более сложную и неоднозначную с этической точки зрения вещь? Таким образом, клонирование может занять большее место в фильмах, чем в реальной жизни, потому что денег просто нет.И то, что мы можем что-то сделать, не означает, что нам это нужно.
Ян: Ваши ученые были настолько озабочены тем, смогут ли они это сделать, что не задумывались, стоит ли им это делать.
Abby Tang: Итак, в исследовании этого видео я наткнулся на один очень интересный лакомый кусочек, а именно объявление о клонированном человеческом ребенке Еве, родившемся 26 декабря 2002 года.


